

МИР ЗНАНИЙ
А.А. БОГДАНОВ Б.М.МЕДНИКОВ
Власть над геном
Книга для внеклассного чтения
учащихся 9—10 классов средней школы
МОСКВА «ПРОСВЕЩЕНИЕ» 1989
| {1} |
ББК 28.04 Б73
Рецензенты:
член-корреспондент АН СССР, зав. кафедрой химии природных
соединений МГУ им. М. В. Ломоносова М. А. Прокофьев;
учитель-методист школы № 151 Москвы З. М. Спитковская
Богданов А. А., Медников Б. М.
Б73 Власть над геном: Кн. для внеклас. чтения учащихся 9—10 кл. сред. шк. — М.: Просвещение, 1989. — 208 с, ил. — (Мир знаний). ISBN 5-09-000440-4
В книге увлекательно рассказано об одной из самых важных отраслей биотехнологии — генной инженерии, направленном изменении наследственности. Школьник узнает о внедрении генной инженерии в медицину, сельское хозяйство, нефтяную и газовую промышленность, а также о перспективах развития этой отрасли современной биологии. Оригинальные рисунки и схемы помогут лучше понять научно-познавательные очерки о генной инженерии, о власти человека над геном.
ISBN 5-09-000440-4
© Издательство «Просвещение», 1989
| {2} |
Как бы человечество ни ушло по пути прогресса, наш XX в. навсегда останется в его памяти. Люди всегда будут помнить, что этот век был отмечен тремя важнейшими достижениями: люди научились использовать энергию атома, вышли в космос и стали направленно изменять наследственность. Вот три великих успеха, которые наши отдаленные потомки будут помнить даже тогда, когда станут летать от звезды к звезде и победят старость и смерть.
Но если перспективы ядерной физики преподаются в школе, если космонавтов благодаря телевидению мы знаем в лицо, с биологией дело обстоит хуже. Величайшие ее достижения еще не стали известными широким массам, да и школьные программы просто не успевают за развитием науки. Потому мы и написали эту книгу, которую предлагаем на суд читателю.
Следует сказать, что часто книги — учебники и учебные пособия, научно-популярные книги в том числе, пишутся в расчете на «среднестатистического» читателя; но такого в природе не существует. Одни будут читать эту книгу с напряжением, другие — с интересом, третьи не только прочтут, но и заинтересуются генной инженерией и, быть может, захотят связать с этой новой отраслью биологии свою жизнь. И если найдется достаточное количество читателей такой категории, мы будем считать, что потрудились не зря.
А. А. Богданов, Б. М. Медников
| {3} |
Эта книга — рассказ о том, как люди научились направленно изменять наследственность. Что такое наследственность, знают все. Признаки, по которым каждый живой организм, в том числе и человек, отличается от другого, унаследованы ими от родителей. Не наследуются лишь признаки, полученные в течение жизни организма, будь то вырезанный аппендикс, знание математики или умение играть на гитаре.
В давнее время самого понятия «наследственность» не существовало. Коренные жители Австралии, например, еще в начале нашего века считали, что и физические, и духовные качества человек получает не от родителей, а от духа предка, который вселяется в него при рождении, а до того дожидается появления своей смертной оболочки где-нибудь в большом муравейнике или скале причудливой формы. По-видимому, это поверье было широко распространено. Когда в 20-е годы нашего века мальчика-чукчу учитель спросил, как назвали его только что родившуюся сестру, тот очень удивился: «Да ведь это вернулась та сестра, что умерла прошлой зимой».
Причуды наследственности иногда приводят к тому, что ребенок оказывается похожим не на отца и мать, а на гораздо более отдаленного предка. Конан Дойль в «Собаке Баскервилей» описал случай, когда и духовные, и физические черты Гуго Баскервиля возродились в его отдаленном потомке Стэплтоне. Истории о Шерлоке Холмсе выдуманные. Но вот Чарлз Дарвин привел пример, касающийся собаки английского аристократа. Чистокровная собака из породы пойнтеров принесла четырех щенят бело-сизой, совершенно {4} несвойственной пойнтерам окраски. Через два года одного из этих пойнтеров увидел друг владельца и узнал в нем старую собаку Сапфо, когда-то удивлявшую всех необычным бело-сизым окрасом. Когда навели справки, оказалось, что молодой пойнтер — праправнук Сапфо: в нем возродились ее черты — через четыре поколения вполне нормально окрашенных родителей. Эти факты наталкивали на мысль, что наследственность — свойство явно материальное.
В конце концов люди стали понимать, что дело не в духах предков: предки возрождаются в потомках лишь потому, что передают по цепи поколений нечто такое, что определяет их признаки. Тогда и появились пословицы вроде «От худого семени не жди доброго племени», «Яблоко от яблони не далеко падает». Возникли и первые родословные — монархов, аристократов, собак и породистых лошадей. Сначала они были устными. Перечислить своих предков по возможности вплоть до основателя рода считалось совершенно необходимым для полноправного члена рода.
Самая древняя из родословных домашних животных изображена на обломке глиняной печатки, найденной в Эламе (междуречье между Тигром и Евфратом). Мы видим, что 6000 лет назад люди не только разводили лошадей, но и имели отдельные их породы. На печатке четко видны наследственные признаки лошадей — прямой, выпуклый и вогнутый профиль и особенности гривы (торчащая и свисающая). У некоторых грива, по-видимому, отсутствовала, как у лучших современных туркменских аргамаков. Возможно, это не родословная, а своего рода отчет о скрещивании для выведения наилучших пород лошадей.
У растений половое размножение, а значит, и возможность скрещивания открыл лишь в 1694 г. немецкий ученый Р. Я. Камерариус, хотя искусственное опыление финиковой пальмы на Востоке, в том же Двуречье, практиковалось тысячи лет. Финиковая пальма — растение двудомное, и садоводы поняли, что без мужских растений урожая не получить. Но пальма считалась исключением.
Поняв значение наследственности, люди начали задумываться над тем, как ее изменить. Всем хотелось иметь более быстрых лошадей, более могучих тягловых быков и молочных коров, наилучшие плоды и овощи {5} и детей определенного пола. В примитивных человеческих обществах чаще всего ценились мальчики. Престол наследовался, как правило, по мужской линии, а в древнем Китае только сын имел право приносить жертвы духам предков. Увы, самый всемогущий монарх, имевший абсолютную власть над жизнью и смертью своих подданных, не мог гарантировать себе наследника мужского пола, как, впрочем, не можем мы сделать этого и сейчас.
Желания людей всегда опережали имеющиеся в их распоряжении средства. Поэтому до эпохи научных прогнозов жрецы «предсказывали» будущее по полету птиц и кишкам жертвенных животных, шаманы лечили заклинаниями, алхимики пытались получить золото из мочи, а мечтатели всех времен и народов «достигали» Луны на птичьих крыльях и воздушных шарах.
Мечта об управлении наследственностью нашла воплощение в той системе взглядов, которую назовем гомеопатической. Как известно, гомеопаты лечат «по подобию»: если какое-нибудь вещество в больших дозах, например, повышает температуру или вызывает расстройство желудка, в микроскопических дозах оно, по их мнению, должно вызывать обратный эффект. Хотя гомеопаты в своих поисках нашли действительно эффективные лекарственные средства, такой подход сейчас кажется наивным. Но именно он твердо укоренился в попытках изменить наследственные свойства. Каннибалы дикарских племен поедали мозг, сердце и печень убитого врага, чтобы унаследовать его ум и храбрость (обычай сохранился до наших дней: самураи второй мировой войны называли его кимотори). Библейский герой Иаков открыл простой и эффективный способ изменения масти овец: чтобы родился пегий ягненок, нужно показать овце тополевый или миндальный прутик с удаленной полосами корой.
А герой Дюма ван Берле вывел черный тюльпан в одноименном романе. «Он спрятал в темном помещении те семена, которые должны были дать черный цвет, выставлял на солнце или на свет лампы те, которые должны были дать красный, ставил под отраженный от воды свет те, из которых должны были вырасти белые тюльпаны».
Были и рецепты получения в потомстве определенного {6} пола по заказу. Так, в племени масаи в Африке твердо верили, что, если дать будущей матери ложку львиного жира, родится мальчик, по храбрости не уступающий льву, а пол-ложки гарантирует рождение девочки. Академик Б. Л. Астауров, много сделавший в изучении наследуемости пола, уже в наши дни грустно писал, что получает десятки писем, в которых излагаются как научные открытия рецепты получения мальчика и девочки, не менее забавные и столь же «обоснованные».
И все-таки люди изменяли наследственность, причем порой даже не подозревая об этом. Чарлз Дарвин показал, что началось это с бессознательного отбора, когда хозяева сохраняли в первую очередь самые ценные экземпляры домашних животных и растений. О направленном изменении пород даже не думали. Тем не менее они менялись из поколения в поколение.
Когда люди поняли значение наследственности, появился новый метод — целенаправленный подбор лучших производителей и вполне сознательный отбор, в котором на племя оставлялись самые лучшие потомки. С тех пор выведение нужных в хозяйстве сортов растений и пород животных пошло семимильными шагами. Началось это сравнительно недавно. 12—11 тыс. лет назад резкое увлажнение климата привело к гибели обильные стада травоядных животных Евразии. Мамонты и дикие лошади, первобытные быки, бизоны, антилопы и северные олени стали вымирать — резко сократилась их численность или они откочевали в другие места. А ведь эти животные были основой тогдашнего хозяйства. В таких условиях человечество ухватилось за соломинку — стебель однолетнего злакового растения.
Сравните тонкие мочалистые корни дикой моркови и современную каротель, яблоню-дичок и культурные сорта; вспомните все разнообразие пород лошадей, рогатого скота и собак, тяжелые колосья пшеницы — прогресс кажется несомненным. Большинство пород и сортов уже не может размножаться без помощи человека. Самые яйценоские куры, несущиеся чуть ли не каждый день в году, утратили инстинкт насиживания, без инкубаторов они вымрут. У кукурузы в початке зерна плотно закрыты листовыми обвертками, так что потери урожая минимальные, но рассеваться сама она {7} не может. А некоторые растения вообще семян не образуют — вспомним бананы и махровоцветные растения наших цветников.
И все же, несмотря на успехи селекции, наследственность нужных человеку форм изменялась не так быстро, как хотелось бы. Человечество росло, а производство в первую очередь пищи отставало. В обществах с несовершенными социальными отношениями голод оставался вполне реальной угрозой. В слаборазвитых странах, где успехи хозяйства до последнего времени искусственно тормозились, он и сейчас уносит немало жизней.
Значительную роль в отставании производства сельскохозяйственных продуктов сыграло то, что вплоть до начала нашего века селекция и гибридизация не имели твердой научной основы — науки о наследственности и изменчивости, которую мы сейчас называем генетикой. Наполовину искусство, наполовину ремесло, собрание иногда противоречащих друг другу правил, полученных из наблюдений и опытов, — вот чем было тогда растениеводство и животноводство.
Как начиналась генетика как наука. Наука о наследственности (и изменчивости) ведет начало от блестящих опытов Грегора Иоганна Менделя, в 60-х годах прошлого века скрещивавшего разные сорта гороха в крошечном палисадничке под окнами своей кельи августинского монастыря в городе Брно (Чехословакия). Работа Менделя в XIX в. прошла незамеченной. Скромный ученый-любитель на 35 лет опередил современное ему развитие науки. Лишь в 1900 г. законы Менделя были переоткрыты сразу тремя учеными — Г. де Фризом, К. Корренсом, Э. Чермаком. Этот год и считается начальным для генетики.
В начале нашего века генетика развивалась очень бурно и уже в 20-е годы вполне заслуженно могла гордиться своими успехами. Многие из полученных в то время результатов были развиты и продолжены трудом последующих поколений ученых, что-то было исправлено, но основные выводы и сейчас неоспоримы.
Как излагались в середине 20-х годов основные выводы генетики? Попробуем повторить их по книгам тех лет.
1. Все наследственные свойства живых организмов, а точнее развитие этих свойств в индивидуальном {8} развитии организма, определяются определенными материальными, дискретными, т. е. отделяемыми друг от друга, частицами. Их назвали генами. Именно гены передаются из поколения в поколение при делении клеток.
2. При каждом делении клеток гены должны размножаться, удваиваться в числе. Иначе они просто потеряются; к примеру, через 50 поколений в клетках их будет в 250 раз меньше, чем у клетки-родоначальницы.
3. Гены у высших организмов — эукариот — расположены в ядрах клеток; лишь немногие встречаются в цитоплазме клеток и определяют так называемый матроклинный тип наследования — по женской линии. Ведь мужская половая клетка цитоплазмы практически лишена (сейчас известно, что внеядерные гены не «плавают» в цитоплазме, а встроены во внутриклеточные органеллы — митохондрии, а у растений еще и в пластиды).
4. В ядрах гены лежат не «россыпью», а образуют линейные структуры хромосомы, хорошо различимые в оптический микроскоп. Число хромосом варьирует от двух (у малярийного плазмодия) до тысячи и больше (у некоторых растений и простейших). «Вещество наследственности» — хроматин ядра — конденсируется в хромосомы при делении клеток, в растущей клетке хромосомы не видны. Ни ядер, ни хромосом у прокариот — бактерий — не видно, но гены, очевидно, имеются и у них, так как есть наследственные свойства.
5. При половом размножении, при слиянии мужской половой клетки с женской, потомок получает один набор хромосом от отца, другой — от матери. Поэтому все клетки организма имеют двойной набор хромосом — отцовский и материнский. Редко наблюдается партеногенетическое размножение (без оплодотворения), когда начало организму дает неоплодотворенная яйцеклетка или клетка тела (соматическая).
6. При образовании половых клеток (гамет) число хромосом уменьшается вдвое (гаплоидный набор хромосом — n). Нормальное (диплоидное число — 2n) восстанавливается при слиянии половых клеток. Этот процесс предугадал еще Мендель: ведь в противном случае число хромосом удваивалось бы с каждым новым поколением и жизнь, конечно, скоро стала бы невозможной. {9}
7. При обычном делении клеток ядерное вещество умножается вдвое, а затем делится между дочерними клетками (митоз). Хромосомы при этом расщепляются в продольном направлении. При образовании половых клеток ядро делится дважды, а хромосомы только один раз (мейоз), потому в каждую гамету попадает лишь половина хромосом диплоидного набора.
8. При мейозе хромосомы, полученные от разных родителей, образуют пары. Парные хромосомы, одна из которых происходит от материнского организма, а другая от отцовского, называют гомологичными хромосомами; не расщепляясь вдоль, они расходятся по вновь образующимся половым клеткам.
9. Расхождение отцовских и материнских хромосом по новым гаметам — процесс случайный. Число вариантов здесь равно 2 в степени, равной числу хромосом в гаплоидном наборе: у плодовой мушки-дрозофилы, например, из 24 = 16, а у кролика — 222 = 4 385 000. Случайный набор хромосом в мужской гамете плюс случайный набор в женской — это исключает вероятность возникновения совершенно одинаковых оплодотворенных яйцеклеток — зигот, т. е. одинакового потомства. (Вы спросите: а как же однояйцевые близнецы? Они генетически идентичны, одинаковы, потому что развиваются из зиготы, разделившейся один или два раза, реже больше.)
10. Случайное расхождение хромосом при мейозе не единственная причина возникновения разнообразия в потомстве. Выстроившись попарно, гомологичные хромосомы могут обмениваться частями. Этот процесс получил название кроссинговера (перекреста). В результате гены, полученные от отца и матери (из разных гомологичных хромосом), могут оказаться сцепленными в одной хромосоме.
11. Генетики разгадали, почему в одних случаях на свет появляется мальчик, а в других — девочка. У высших организмов пол определяется хромосомами. У женщин две гомологичные половые хромосомы — XX, у мужчин пол, как говорится, гетерогаметен — одна хромосома X, другая Y. Так пол определяется у человека, мушки-дрозофилы и многих других животных. Такой же механизм описан и для ряда двудомных растений, например реликтового дерева гинкго. (Интересно, что у птиц, бабочек и некоторых рыб, наоборот, мужской пол гомогаметен, а женский гетерогаметен.) Ясно, что после {10} мейоза, когда число хромосом уменьшается вдвое, все яйцеклетки в первом случае будут иметь хромосому X, а сперматозоиды — или X, или Y. В зависимости от того Х- или Y-сперматозоид сольется с яйцеклеткой, набор получится XX (девочка) или XY (мальчик). Считалось, что вероятность этих событий 50 × 50. Однако потом удалось установить, что Y-сперматозоиды более жизнестойки и процент новорожденных мальчиков существенно выше. Видимо, этот механизм возник, чтобы компенсировать повышенную смертность мужчин на охоте и войне. Любопытно, что, если в семье одна за другой рождаются девочки, значит, в этом «повинен» отец (его Y-сперматозоиды отличаются пониженной жизнестойкостью).
Хромосомный механизм определения пола развился не сразу — у рыб половые хромосомы трудно, а то и невозможно отличить друг от друга, и пол часто определяется внешними условиями. Молодые угри, например, в пресных водах становятся самками, а в устьях рек — самцами.
12. Гены не оказались стабильными на 100%. Редко, с частотой в среднем 10–5 на поколение, гены менялись, и это находило отражение в изменении признаков организма. Такие наследственные изменения назвали мутациями. Удалось установить, что частота мутаций возрастает при воздействии жесткого излучения, например рентгеновских лучей и некоторых химических веществ. Это вселяло надежды на разработку методов направленного изменения наследственности, если бы не одно досадное обстоятельство.
13. Мутагенез (мутационный процесс) оказался процессом случайным. Какой ген, скажем, при облучении рентгеном изменится и в какую сторону, предсказать невозможно. Ведь какой бы мы ни использовали фактор внешней среды, чтобы воздействовать на наследственность, она изменялась случайным образом, без всякого соответствия мутагенному фактору.
14. И все же мутационный процесс можно использовать для изменения наследственных свойств. Случайные и непредсказуемые превращения генов (мутации) приводят к тому, что практически каждый ген оказывается представлен несколькими, двумя и более, разновидностями. Эти формы генов назвали аллеломорфами или просто аллелями. Г. Мендель в своих опытах как
| {11} |
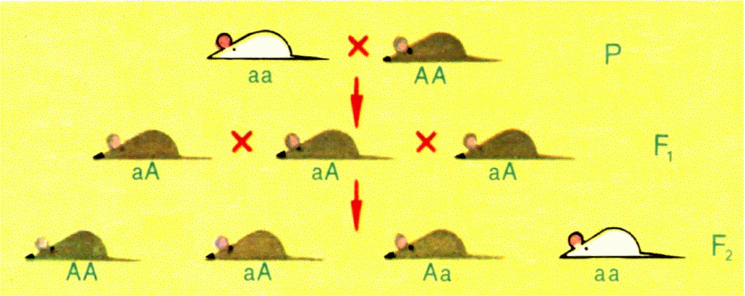 |
Рис. 1. Схема наследования признаков. При скрещивании мышей, гомозиготных по рецессивному (аа) и доминантному (АА) аллелям, гибриды первого поколения имеют доминантный признак (серый цвет). Во втором поколении рецессивный признак выщепляется в среднем в 25% случаев. |
раз и наблюдал наследование разных аллелей одного гена (один аллель вызывал, например, желтую окраску горошин, а другой — зеленую). Ясно, что организм может иметь не более двух аллелей одного гена — каждый в своей гомологичной хромосоме; соответственно в гамете может быть только по одной гомологичной хромосоме от пары и только по одному аллелю. Разные аллели могут отличаться по силе воздействия на развитие признаков (рис. 1). Если, например, аллель, вызывающий появление желтого цвета горошин, подавляет расположенный в парной хромосоме аллель зеленого цвета, он доминантный, а зеленый соответственно рецессивный. Рецессивный аллель проявляется в признаке организма, в фенотипе, только в том случае, если имеется в обеих гомологичных хромосомах. Тогда говорят, что организм гомозиготен по данному гену. Иногда, впрочем, оба аллеля обладают одинаковой силой воздействия на развитие признака. Их называют кодоминантными.
Проводя скрещивание и отбор в потомстве, мы можем получать породы животных и сорта растений, гомозиготные по тому аллелю, который нам нужен. С развитием генетики селекция обрела прочный научный фундамент. Но для того чтобы вести селекционную работу, нужен материал для нее: как можно больше форм генов, накопленных эволюционным процессом. Это хорошо понимал наш замечательный генетик академик Н. И. Вавилов, задавшийся целью собрать со всего земного шаpa {12} коллекцию сортов всех сельскохозяйственных растений.
Коллекция Н. И. Вавилова — это живой запас генов, с которым и работают селекционеры, комбинируя их в разных сочетаниях. С домашними животными дело до последнего времени обстояло хуже. Многие ценные местные породы кур и лошадей, рогатого скота и свиней были потеряны или оказались близки к исчезновению. Лишь в последние годы по инициативе академика Д. К. Беляева стали создавать для них «заповедники». В ряде случаев естественного запаса аллелей оказалось недостаточно, и генетики разработали методы, повышающие частоту возникновения мутаций. Появились кобальтовые пушки, обрабатывающие семена и растения жестким излучением, а также супермутагены — вещества, вызывающие мутации в 100% случаев.
Можно ли сказать, что с успехами генетики мы обрели полную власть над геном, получили возможность изменять наследственность в заданном направлении? К сожалению, нет.
Как генная инженерия возникла... до своего рождения. Если же говорить конкретно: чего не хватало научно обоснованной гибридизации и селекции? В первую очередь нужно было преодолеть недостатки, лежащие в природе самой гибридизации. Скрещивая представителей разных пород, гибридизатор объединял генотипы — совокупности множества генов, вместе с нужным для него признаком получал много ненужных, а то и вредных. Образно говоря, получить богатое наследство можно было только вместе с доброй сотней «неимущих родственников». Вот если бы вставить в хромосому какой-нибудь определенный ген по желанию. Увы, на уровне классической генетики это казалось совершенно невозможным. Кроссинговер, позволяющий переносить ген из одной хромосомы в другую, также случайный процесс.
Второе затруднение заключалось в том, что гибридизация успешно идет только внутри вида. Межвидовые гибриды часто оказывались нежизнеспособными или бесплодными, а между более отдаленными формами не получались вообще. Собственно само понятие биологического вида теперь определяется через генетическую изоляцию. По-видимому, это общебиологический принцип. Наш крупный генетик Н. В. Тимофеев-Ресовский {13} полагал, что именно генетическая обособленность одного вида от другого и делает возможной прогрессивную эволюцию. Если бы виды скрещивались без всяких ограничений, до появления человека и открытия генетики дело бы просто не дошло. Землю и сейчас населяли бы простейшие организмы, хорошо приспособленные к самым разнообразным условиям, но к прогрессивной эволюции неспособные.
Полезный признак, возникнув в одном виде, там и остается — в предковом виде и его потомках. Успехи эволюции в одной линии не могут быть заимствованы другими линиями. В результате, как справедливо писал С. Лем, старый человек — существо беззубое, хотя эта эволюционная задача несколько раз успешно была решена (у грызунов, акул и т. д. зубы растут всю жизнь). Генетики разработали приемы, позволяющие понизить уровень барьера, возникающего между близкими видами при скрещивании (главным образом у растений). Но все они были применимы лишь при гибридизации близких форм. Недаром на Украине бытует выражение «Як на вербе груши» как синоним чего-то небывалого, невозможного.
Дальнейшее развитие генетики тормозилось тем, что ученые не знали, из какого вещества (или веществ) состоит ген. Да и вещество ли это — в том смысле, как его понимают химики? Успехом пользовалась идея о том, что наследуются не химические соединения, а процессы аутокатализа, когда все характерные для организма вещества сами запускают и ускоряют свой синтез. Более того, некоторые генетики даже гордились тем, что, не зная материальной природы генов, обозначая их алгебраическими символами (доминантный аллель — прописной буквой, рецессивный — строчной), они уверенно могут предсказать их поведение по изменению свойств фенотипов при скрещивании. Так же врачи тогда (да и сейчас) ставили диагноз «грипп», не нуждаясь в электронном микроскопе, чтобы увидеть частицы вируса. Достаточно внешних признаков — высокой температуры и насморка у больного. Но уже в 20-е годы были сделаны открытия, обещавшие революцию в генетике.
Так как микроорганизмы из надцарства прокариот имеют хорошо наследуемые признаки (способность к синтезу каких-либо соединений, патогенность, цвет и форма колоний, выросших на твердой среде, и т. д.), {14} никто не сомневался, что гены есть и у микробов. Но у микробов нет ни ядра, ни хромосом, видимых в световой микроскоп, как будто бы нет и полового процесса, приводящего к обмену генами и перемешиванию их в каждом новом поколении. Ставший стандартом для высших организмов анализ скрещиваний (гибридологический анализ) здесь не подходил.
В 1928 г. Ф. Гриффитс исследовал две разновидности, два штамма бактерий — пневмококков. Они образовывали на твердой питательной среде колонии разной формы (с ровным краем и с зазубренным) и, главное, по-разному действовали на подопытных мышей. Один штамм вызывал у мышей смертельную пневмонию (воспаление легких), другой был безвредным. Ф. Гриффитс убил клетки «смертельного» штамма высокой температурой и смешал их с живыми клетками штамма безопасного. Результат получился сенсационный: безвредный штамм приобрел способность убивать мышей! Что из этого следовало? То, что из убитых и разрушенных клеток патогенного штамма выделяется какое-то вещество, условно названное фактором Гриффитса. Он может включаться в живые клетки, изменяя наследственные свойства организма. Не ген ли это?
Сейчас мы знаем, что Ф. Гриффитс не был первым. За шесть лет до него крупнейший наш микробиолог и вирусолог, создатель вирусно-генетической теории возникновения рака Л. А. Зильбер вводил в брюшную полость морской свинки, зараженной сыпным тифом, мешочек из полупроницаемой пленки (коллодия). В мешочке была культура безобидной крупной бактерии — протея обычного. Побыв некоторое время в организме больной свинки, протей обрел способность склеиваться и выпадать в осадок (агглютинировать) под действием сыпнотифозной сыворотки. Это очень специфическая реакция. Организмы отвечают на появление в них чужих белков и полисахаридов (антигенов) синтезом новых белков — антител. Антитела (мы теперь их называем иммуноглобулинами), присоединяясь к молекулам чужих белков и к оболочкам бактерий и вирусов, склеивают их, переводя в безопасное для организма состояние. Антитело действует только против своего антигена, и потому противодифтерийная сыворотка не может вылечить от тифа. Значит, опыты Л. А. Зильбера можно истолковать так: какое-то вещество, выделяемое сыпно-тифозным {15} микробом, проходя через полупроницаемую мембрану (через нее проходят молекулы и вирусы, но не бактерии), изменяет наследственные свойства протея, делая его похожим на сыпнотифозную палочку. Полученный штамм (Х-протей) стойко передавал свои новые заимствованные от сыпнотифозной палочки свойства 18 лет, пока не был утерян во время Отечественной войны.
Явление передачи признаков от одного штамма и вида к другому, получившее название трансформации, т. е. превращения, и подсказало путь для выяснения химической природы гена. Следовало только накопить фактор Гриффитса в количестве, необходимом для химического анализа. Задача была не из простых, поскольку в то время в практику лабораторий еще не вошли радиоактивные изотопы и не было ни современных тонких методов разделения, ни способов анализа сверхмикроколичеств неизвестных соединений.
10 лет английские ученые О. Эйвери, С. Мак-Леод и М. Маккарти трудились над выделением, очисткой и анализом фактора Гриффитса, пока в 1944 г. не пришли к выводу, что это вещество, давно и хорошо известное, обнаруженное в изобилии в хромосомах всех организмов и всех половых клетках, — дезоксирибонуклеиновая кислота (ДНК).
С 1944 г. можно вести начало новой отрасли естествознания — молекулярной биологии. Сразу после войны на ДНК «накинулись» во многих лабораториях мира, и открытия посыпались градом.
Пожалуй, никто в то время не заметил, что Л. А. Зильбер в 1922 г. и Ф. Гриффитс в 1928 г. неожиданно для себя и в конечном счете случайно осуществили тысячелетнюю мечту человечества: направленно изменили наследственность, перенеся ген от одного организма к другому. Не имеет значения, что это было проделано на микробах, к тому же в далеких от практической деятельности экспериментах. Начало было положено: перенос единичного гена из одного генома в другой был обнаружен и описан. Можно сказать, что генная инженерия возникла... до своего рождения.
| {16} |
Итак, гены оказались состоящими из ДНК — вещества, которое биохимики, как им казалось, хорошо знали.
Строение ДНК. ДНК — это полимер. Полимерными молекулами химики называют длинные цепочки, состоящие из одинаковых (гомополимеры) или разных (гетеро-полимеры) звеньев — мономеров. В основе мономера ДНК — молекула углевода — пентоза. Обычно в молекулах углеводов отношение атомов кислорода и водорода такое же, как в воде, — 1:2, поэтому общая формула углеводов СnН2nОn.
Углевод ДНК — исключение из правила: в нем не хватает одного атома кислорода (С5Н10О4), поэтому его назвали обескислороженной рибозой — дезоксирибозой.
К каждому остатку дезоксирибозы в ДНК присоединено одно гетероциклическое (азотистое) основание. Их в норме четыре: аденин, гуанин, тимин, цитозин (рис. 2).
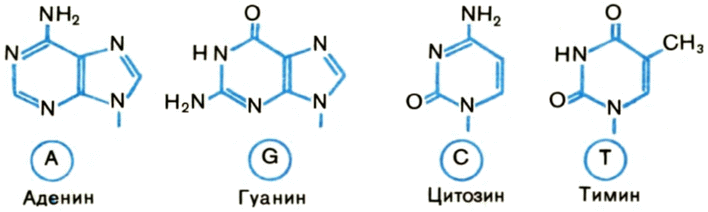 |
Рис. 2. Строение азотистых оснований ДНК. 17 |
| {17} |
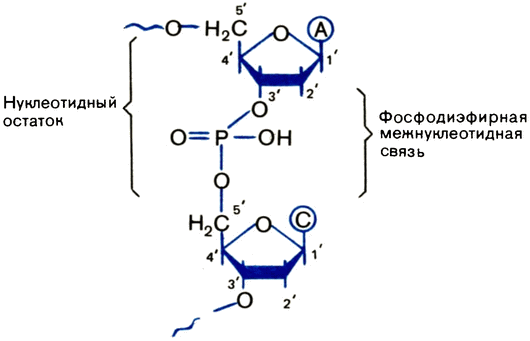 |
Рис. 3. Фрагмент цепи ДНК. Коротко он записывается — АС — |
Гетероциклическими химики называют кольца, слагаемые, кроме углерода, и другими атомами, в данном случае азотом. Соединение основания с сахаром называют нуклеозидом.
Сокращенно основания и соответствующие мономеры ДНК обозначаются латинскими буквами A, G, С и Т. (В популярной литературе и учебниках их обозначают русскими буквами — соответственно А, Г, Ц, Т.) Углевод в ДНК также циклический: связь через атом кислорода образует пятиугольную молекулу. Атомы углерода в ней химики перенумеровали — 1, 2, 3, 4, 5, начиная с того, к которому присоединено основание.
Что сшивает отдельные нуклеозиды ДНК в единый полимер? Химики установили, что сшивки — остатки фосфорной кислоты Н3РО4. Такие связи называют фосфодиэфирными. Фосфодиэфирная связь в природных ДНК возникает между третьим и пятым атомами углерода в соседних пятичленных циклах пентозы, поэтому она называется 3'—5'-связью.
Нетрудно понять, что на одном конце образующегося полимера остается свободным 3'-атом углерода, а на другом — 5'. Эти концы так и называют 3'- и 5'-концами (рис. 3).
Добавим, что нуклеозид с остатком фосфорной кислоты называется нуклеотидом (а точнее, дезоксирибонуклеотидом). Это и есть отдельное звено нуклеотидной цепи ДНК. {18}
Раньше полагали, что ДНК состоит из монотонно повторяющихся блоков — A, G, С, Т. Казалось, что полимер такого простого строения, такая «скучная» и однообразно устроенная молекула не может быть носителем разнообразных наследственных свойств. Но в конце 40-х годов австрийский биохимик Э. Чаргафф показал, что процент оснований G+C может варьировать в широких пределах, изменяясь от одного вида к другому. Значит, в природе может существовать бесконечное количество вариантов ДНК. Если длина полинуклеотида хотя бы тысяча звеньев, то количество вариантов 41000 (это число с шестью тысячами нулей!). Известно, что только двумя символами, например точкой и тире в азбуке Морзе или же нулем и единицей в программах ЭВМ, можно записать какой угодно большой объем информации. Так что кажущаяся простота строения ДНК не помеха для того, чтобы этот полимер выступил в роли «вещества наследственности».
Из анализов Э. Чаргаффа следовало, что в ДНК любого организма количество А всегда равняется количеству Т, а количество G — количеству С. Лишь потом из этого правила нашлись исключения — ДНК некоторых вирусов. Для подавляющего большинства организмов правила Чаргаффа строго соблюдались. Почему это так, стало ясно после работы Д. Уотсона и Ф. Крика, сделавших в 1953 г. одно из величайших открытий в истории естествознания. Они установили, что молекула ДНК — двойная спираль, в которой две полинуклеотидные оси закручены друг вокруг друга и вокруг общей оси (рис. 4).
Цепи ДНК антипараллельны: двигаясь мысленно вдоль длинной оси двойной спирали, в одной цепи мы будем проходить межнуклеотидные связи в направлении 3'—5', а в другой — 5'—3'. Представьте двух змей,
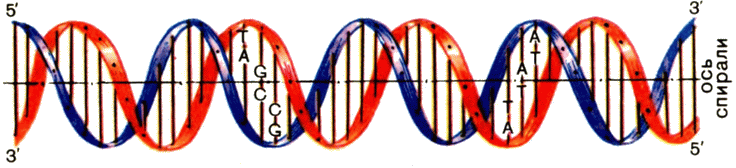 |
Рис. 4. Строение молекулы ДНК. |
| {19} |
 |
Рис. 5. |
скрутившихся в спираль — голова одной к хвосту другой (рис. 5).
Допустим, что голова — 5', а хвост — 3'. Спираль ДНК обычно закручена вправо, как штопор или болт с правой резьбой. Но в некоторых случаях ДНК образует и левую спираль, названную Z-формой.
Что же связывает единичные цепи в двойной спирали? Д. Уотсон и Ф. Крик установили, что антипараллельные последовательности в ней образуют так называемые комплементарные пары. G в одной цепи соединяется с С в другой, так же как А с Т водородными связями, о которых вы имеете представление из школьного курса химии. Эти связи с участием электроположительного водорода (протона) и какого-либо электроотрицательного центра (кислорода, азота). Для существования жизни в земном варианте водородные связи чуть ли не важнее всех прочих: ведь вода кипит при 100° С именно потому, что молекулы ее связаны друг с другом в легкоразрушающиеся глобулы (ассоциаты) связями между кислородными и водородными ядрами. Исчезни эти связи — и все океаны на Земле вскипели бы.
Водородные связи гораздо слабее ковалентных; поэтому двойная спираль распадается на комплементарные половинки, если раствор ДНК подщелочить или нагреть до 100°С. Этот процесс называется денатурацией, он обратим. Если понизить рН раствора или понизить температуру, половинки ДНК, сталкиваясь в хаотическом тепловом движении, в конце концов находят друг друга, пары А—Т и G—С восстанавливаются, и снова возникают двойные спирали. Конечно, скорость этого процесса (ренатурации) зависит от концентрации раствора и от разнообразия последовательностей ДНК. Грубо говоря, чем больше разных генов «денатурируется», тем медленнее восстанавливаются двойные спирали ДНК. Образно говоря, чем разнообразнее груда обуви в {20} прихожей, тем дольше приходится искать галошу под пару.
Так как в двойной спирали ДНК G всегда в паре с С, а А с Т, понятно, почему строго соблюдается правило Чаргаффа. У тех вирусов, которые не подчинялись этому правилу, ДНК оказалась одноцепочечной.
Возможность репликации заложена в самой ДНК. Нетрудно понять, что цепи в ДНК не только антипараллельны, но и комплементарны (А против Т и G против С). Зная последовательность нуклеотидов в одной цепи, мы легко восстановим последовательность в другой.
А теперь расплетем двойную спираль ДНК, разделим слагающие ее цепи и, пользуясь правилом комплементарности, построим на них новые (рис. 6). Две дочерние молекулы, которые мы получили, неотличимы от материнской. Вот и ответ на вопрос: как гены удваиваются в числе при делении клеток. Добавим, что водородные связи, возникающие между парами G и С, А и Т, самые устойчивые. Поэтому процесс удвоения, редупликации, генов очень помехоустойчив, ошибки возникают редко. Это и обеспечивает наследственность, преемственность поколений. Иначе дети бы не походили на родителей, в каждом поколении появлялась бы «ни мышонок, ни лягушка, а неведома зверушка».
Редупликация ДНК идет с затратой энергии и ускоряется в клетках целым комплексом белковых молекул-катализаторов — ферментов, главный из которых называется ДНК-полимеразой. После расплетения двойной спирали ДНК этот фермент последовательно наращивает на полинуклеотидных цепях исходной молекулы ДНК (их называют также матричными цепями) комплементарные им цепи.
Обратите внимание: образование двух новых
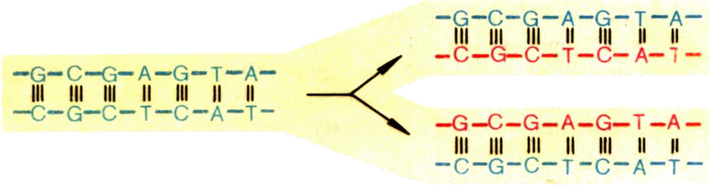 |
Рис. 6. Построение новых нитей ДНК на основе правила комплементарности. |
| {21} |
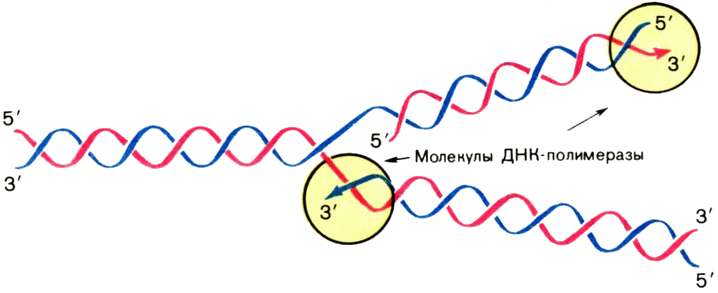 |
Рис. 7. Репликативная вилка. |
комплементарных цепей идет в противоположных направлениях. Это происходит потому, что матричные цепи антипараллельны, а ДНК-полимераза наращивает цепь только от 5'-конца к 3'-концу. То, что изображено на рисунке, называют обычно репликативной вилкой (рис. 7). Ее можно разглядеть в электронный микроскоп.
С ДНК-полимеразой, равно как и с принципом комплементарности оснований, мы еще не раз встретимся на страницах этой книги. А сейчас обратимся к вопросу о том, как реализуется содержащаяся в ДНК наследственная информация.
От ДНК к РНК и обратно. Известно, что основу жизни представляют белки. Функции их в клетках очень многообразны. Сокращается мышца, работает мозг, борется организм с попавшими в него бактериями или вирусами, переваривается в желудке и кишечнике пища, насыщается кровь кислородом, светится светляк, бактерия разъедает камень — во всех разнообразных процессах главную роль играют белки. Одного не «умеют» молекулы белков — размножаться. На них не распространяется принцип редупликации, свойственный генам. Но вся информация, необходимая для постройки белковых молекул, содержится в генах. Если в ядре нет соответствующего гена, организм не будет синтезировать определенный белок. Поэтому уже в 30-е годы было сформулировано правило: один ген — один белок.
У высших организмов — эукариот — белки образуются в цитоплазме клетки, а гены (ДНК) скрыты за оболочкой ядра. Поэтому ДНК непосредственно не может быть матрицей для биосинтеза белка. Эту роль
| {22} |
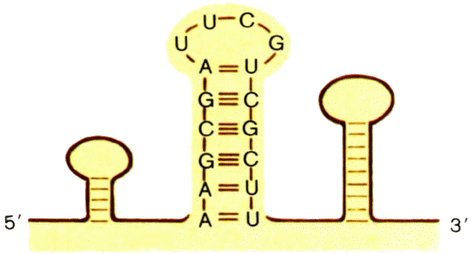 |
Рис. 8. «Шпильки», образуемые поли-нуклеотидной цепью РНК. |
выполняет другая нуклеиновая кислота — рибонуклеиновая (РНК). РНК отличается от ДНК по многим свойствам, но по составу различается незначительно. Вместо дезоксирибоз РНК слагают рибозы (это «нормальные» углеводы — С5Н10О5). РНК вместо тимина содержит урацил (U), отличающийся от тимина только тем, что у него нет метильной группы СН3. Однако РНК практически всегда состоит из одной полинуклеотидной цепи, хотя может образовывать комплементарную двойную спираль с породившей ее однонитчатой ДНК. Впрочем, внутри цепи РНК часто встречаются участки с комплементарными последовательностями нуклеотидов, отчего они скручиваются в двунитчатые «шпильки». Здесь также образуются комплементарные пары оснований, только А—Т заменена на А—U (рис. 8).
РНК синтезируется на ДНК, главную роль здесь играет фермент РНК-полимераза.
Матрицей для синтеза служит одна из цепей двуспиральной ДНК, которая в этом участке расплетается. Молекулярные биологи назвали этот процесс транскрипцией (переписыванием). Транскрипция ДНК строго следует принципу комплементарности, и поэтому образующаяся полинуклеотидная цепь РНК в точности комплементарна матричной нити ДНК и в принципе может образовать с ней идеальную двойную спираль. В следующих главах мы встретимся с такими ДНК — РНК-комплексами. Их называют ДНК — РНК-гибридами, а процесс их образования — ДНК — РНК-гибридизацией. В генной инженерии это свойство часто используют. Далеко не вся ДНК в ядре может образовывать транскрипты. {23} Нетранскрибируемая ДНК служит для каких-то других целей, нам до конца еще неясных. Возможно, она организует структуру хромосом или выполняет обязанности регулятора.
Оказалось, что процесс транскрипции обратим. Известен фермент, синтезирующий на РНК как на матрице полинуклеотидную цепь ДНК. Эта вновь синтезированная ДНК — точная копия той матричной цепи гена, с которой была считана (транскрибирована) РНК. Фермент назвали РНК — зависимой ДНК-полимеразой или, проще, обратной транскриптазой или ревертазой (от слова реверс — обратный ход). Он обнаруживается в составе вирусов, вызывающих перерождение нормальных клеток в опухолевые (раковые). Эти вирусы вместо ДНК содержат РНК — их называют онкорнавирусами (сочетание из слов онкос — рак (греч.), неверно читаемого английского сокращения RNA (РНК) и слова вирус). Обратная транскриптаза вируса переводит его в форму ДНК, которая, включаясь в хромосому клетки, делает ее способной к неконтролируемому, злокачественному росту. Обратная транскриптаза стала одним из основных инструментов генных инженеров.
От РНК к белку. Генетический код. Вернемся к синтезу белка. Мы видим, что не сами гены (ДНК), а их РНК-копии служат матрицами для синтеза белковых молекул. Такие РНК называют информационными (иРНК) или матричными (мРНК). Их можно сравнить с рабочими чертежами (синьками), которые поступают в цеха завода (в нашем случае в цитоплазму), тогда как основные чертежи (ДНК) остаются в «конструкторском» бюро — ядре. По рабочим, матрицированным чертежам синтезируются белки.
Белки тоже полимерные макромолекулы: они состоят из полипептидных цепей, образованных остатками аминокислот. Вообще аминокислотой можно назвать любое соединение, содержащее одновременно аминогруппу (NH2) и группировку органической кислоты — карбоксильную (СООН). Число возможных аминокислот не очень отличается от бесконечности, но белки образуют только 20. Белковую цепочку называют полипептидной, потому что аминокислотные остатки в ней связаны пептидными связями (рис. 9): аминогруппа присоединяется к карбоксильной, при этом отщепляется молекула воды.
Ясно, что на одном конце полипептидной цепочки
| {24} |
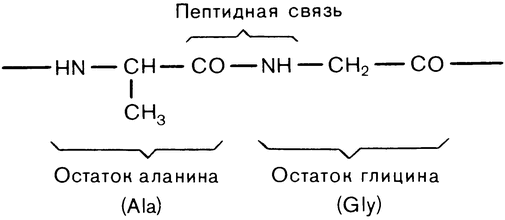 |
Рис. 9. Фрагмент полипептидной цепи. |
остается свободная аминогруппа, а на другом — карбоксильная. Эти концы и называют N-конец и С-конец. Все разнообразие белковых молекул в природе создается различием в длинах их полипептидных цепей и, главное, различным чередованием аминокислотных остатков в этих цепях.
Чередование аминокислотных остатков, или, иными словами, линейная последовательность расположения аминокислотных остатков в белковой молекуле, запрограммировано в нуклеотидной последовательности его гена (ДНК). Код, с помощью которого осуществляется такое программирование, получил название аминокислотного генетического кода. Мы часто будем встречаться с термином кодон, под которым понимают нуклеотидную комбинацию (т. е. комбинацию из A, G, Т и С), кодирующую один данный аминокислотный остаток.
Для того чтобы расшифровать аминокислотный генетический код, потребовалось более 10 лет упорнейшего труда целого научного коллектива. Одно наиболее общее свойство этого кода можем вывести и мы с вами. Известно, что в ДНК имеется четыре вида оснований — A, G, С и Т (в ее РНК-копии тоже четыре — A, G, С и U). Белки же построены из 20 видов аминокислот. Если бы код был однобуквенным, то мы бы смогли закодировать только 4 аминокислоты из 20. Двухбуквенного кода (т. е. с кодонами типа GA, AG, AA, CU и т. д.) также недостаточно, так как с его помощью можно закодировать только 42 = 16 аминокислот из 20. А вот трехбуквенным кодом (43 = 64) сочетания из А, Т, G и С можно закодировать все 20 аминокислот с избытком.
Трехбуквенность кода была доказана и в лаборатории английского ученого Ф. Крика. В тех же опытах было обнаружено, что два кодона, кодирующие соседние аминокислотные остатки, располагаются в полинуклеотидной {25} цепи друг за другом, причем между ними нет вставок и они не перекрываются. Такой код называют неперекрывающимся кодом без запятых.
Например, |
AAU |
GCG |
кодон I |
кодон II |
Генетический код оказался вырожденным, т. е. один и тот же аминокислотный остаток мог кодироваться разными кодонами. Нечто похожее было в старой русской азбуке: там тоже были буквы, читавшиеся одинаково («е» и «ь», «i» и «и», «ф» и «В»). Наш код вырожден неравномерно: аргинин, например, кодируется шестью кодонами, а метионин только одним.
В 1966 г. совместными усилиями ученых многих стран была завершена расшифровка генетического кода. Вот таблица, в которой даны кодоны для иРНК (рис 10).
Из нее видно, что 20 аминокислотам соответствует 61 кодон. Один, реже два из оставшихся трех кодонов стоят в конце кодирующей последовательности. Они соответствуют пропускам между словами в тексте.
Генетический код оказался универсальным для всей живой природы: бактерия, тигр и гвоздика используют одинаковые кодоны для соответствующих аминокислотных остатков. Лишь в особых внутриклеточных структурах — митохондриях, снабжающих клетки эукариот энергией, найдены незначительные отклонения от общего кода. Это свойство кода имеет огромное практическое значение: из него следует, что гены одного организма могут быть перенесены в любой другой организм (а не только из одной бактерии в другую, как это сделал Гриффитс) и в любой чужеродной клетке содержащаяся в них программа может быть использована для синтеза полноценных белковых молекул.
Ф. Крик первым подметил, что между кодонами в РНК и аминокислотами не наблюдается никакого соответствия или химического сродства, и сделал отсюда вывод о существовании какой-то молекулы-посредника, «узнающей» одновременно и тройку нуклеотидов, и кодируемую ими аминокислоту. Эта догадка блестяще подтвердилась: посредниками оказались также молекулы РНК небольшой длины — транспортные РНК (тРНК). На одном из концов тРНК имеется последовательность из трех нуклеотидов, комплементарная кодону (ее называют
| {26} |
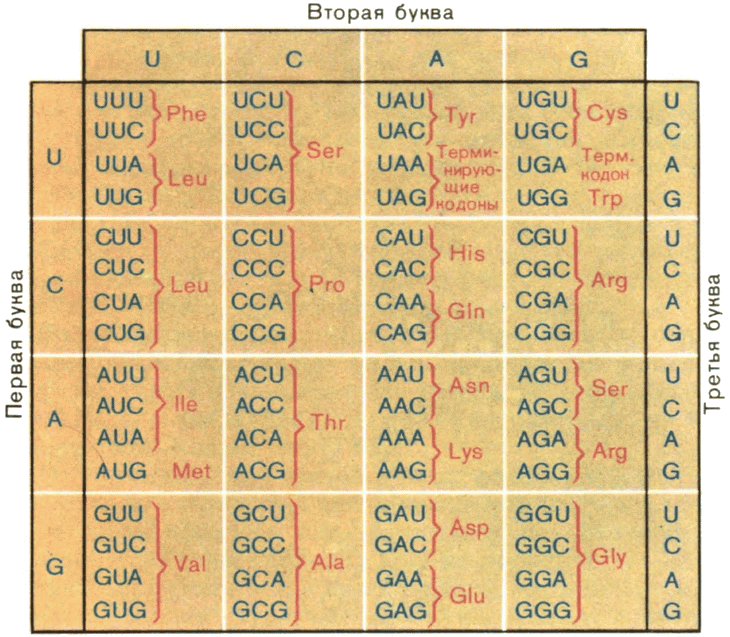 |
Рис. 10. Таблица аминокислотного генетического кода (кодовый словарь) Phe — фенилаланин; Leu — лейцин; Не — изолейцин; Met — метионин; Val — валин; Ser — серии; Pro — пролин; Thr — треонин; Ala — аланин; Туг — тирозин; His — гистидин; Gin — глутамин; Asn — аспарагин; Lys — лизин; Asp — аспарагиновая кислота; Glu — глутаминовая кислота; Cys — цистеин; Тгр — триптофан; Arg — аргинин; Gly — глицин. |
антикодоном). А на другой присоединяется соответствующая этому кодону аминокислота (рис. 11). Связь кодон — антикодон временная, и в ней могут образовываться не только стандартные, канонические пары А—U и G—С, но и неканонические, менее прочные.
С иРНК связывается, таким образом, не тРНК, а комплекс ее с соответствующей аминокислотой. Образование этих комплексов катализируется специальными ферментами — аминоацил-тРНК-синтетазами.
Легко догадаться, что каждая аминокислота должна иметь, по крайней мере, одну соответствующую ей тРНК. А так как код вырожденный, «сортов» тРНК гораздо больше 20.
| {27} |
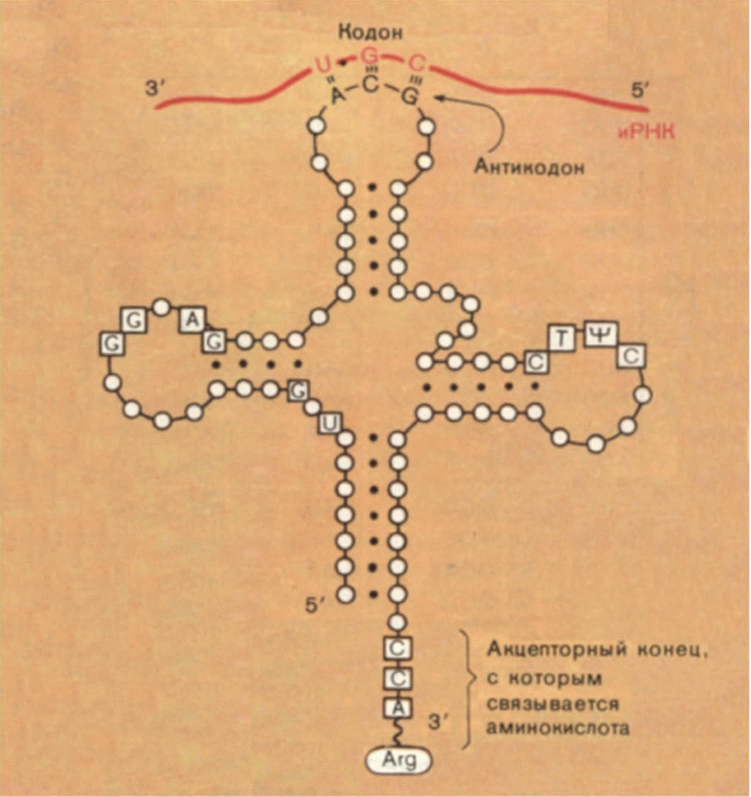 |
Рис. 11. Схема структуры транспортной РНК и кодон-антикодоновых взаимодействий. Нуклеотидные остатки в тРНК изображены кружками. В квадратах находятся те нуклеотидные остатки, которые всегда присутствуют в тРНК в этих положениях. (Обратите внимание на то, что кодон в иРНК нужно «читать» справа налево, так как 5'-конец РНК находится справа.) |
Обратите внимание на еще одну тонкость. Где начало и где конец полипептидной цепи в белке? Установлено, что полипептиды в цитоплазме клеток синтезируются от N-конца к С-концу. N-конец договорились считать начальным. А он соответствует 5'-концу иРНК. Следовательно, 5'-конец иРНК начальный. Но ведь транскрипция, как и редупликация гена, идет так, что {28} матричная нить прочитывается в направлении 3'—5'. Получается, что генетическая информация «перепечатывается» с конца, а читается, как водится, с начала!
Чтобы завершить эту картину, нам остается только добавить, что встреча тРНК, несущей на себе свою аминокислоту, с иРНК происходит на рибосоме. Рибосома, в свою очередь, построена из белков и РНК. Это уже третий класс РНК (рибосомные РНК).
События, происходящие на рибосоме, проще всего изобразить на схеме. Обратите внимание, что после образования каждой пептидной связи и ухода освободившейся тРНК иРНК перемещается на один кодон.
Рибосома начинает «читать» иРНК (молекулярные биологи называют синтез белка на рибосоме трансляцией) со строго определенного кодона (обычно им служит AUG), а заканчивает, как мы уже говорили, на терминирующем кодоне (рис. 12).
Многое из того, о чем мы сейчас рассказали, вы уже знаете из школьных учебников химии и биологии. Сейчас же вы познакомитесь с понятиями, более сложными и по своей новизне в учебники еще не попавшими. Постарайтесь запомнить все новые термины, которые вам попадутся. Не зная их, вы не поймете следующих глав.
Клетка управляет генами. Вскоре после разгадки генетического кода ученые поняли, что сделано было самое легкое, осталось, как это всегда бывает, самое трудное. В самом деле, что «запускает» в клетке одни гены и «выключает» работу других? Ген, кодирующий пищеварительный белок — пепсин, задействован только в специализированных клетках слизистой оболочки желудка. Что было бы, если бы он включился, начал транскрибироваться, например, в клетках нервной системы? Человек попросту переварил бы свой мозг. В конечном счете одна клетка отличается от другой, один орган развивается, отличаясь от другого, и один вид организмов отличается от другого только тем, что у них транскрипция идет с разных генов и разные белки синтезируются в разных количествах. Значит, основа развития организма даже не те гены, в которых закодированы аминокислотные последовательности белков (их называют структурными). Должна существовать какая-то система регуляции, включающая в определенное время одни гены и выключающая другие.
Такая система также входит в состав генома, какие-то
| {29} |
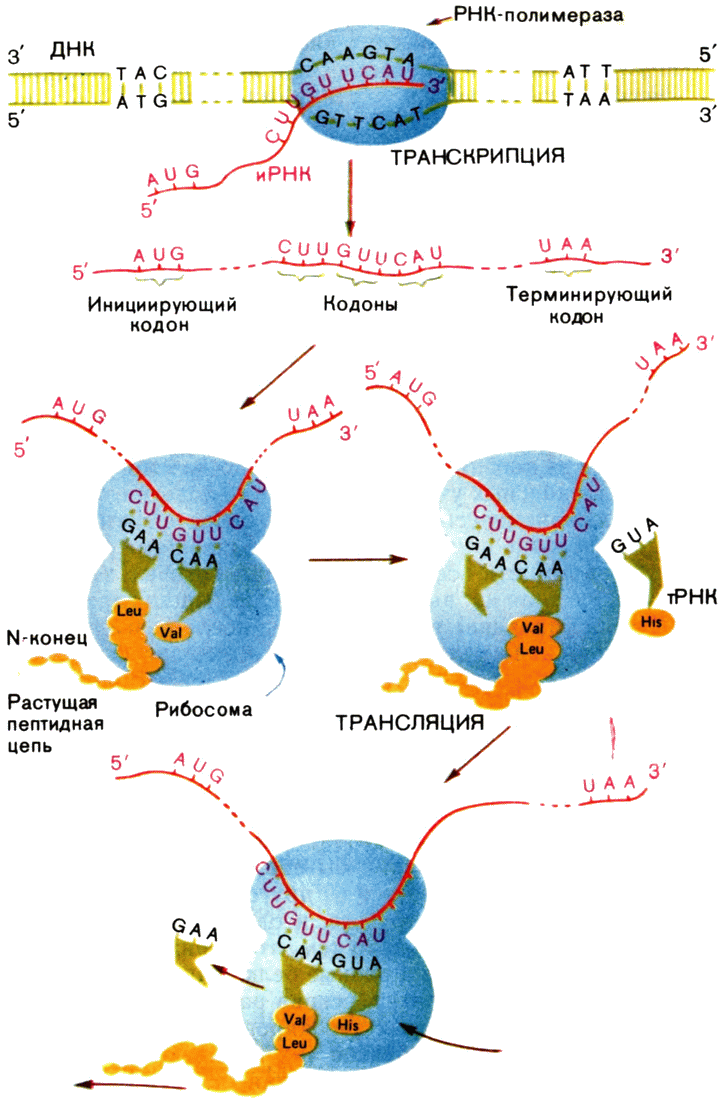 |
Рис. 12. Схема транскрипции (синтеза РНК на ДНК) и трансляции (синтеза белка на рибосоме). |
| {30} |
последовательности ДНК должны быть регуляторными. Клетки млекопитающих способны синтезировать около 50 тыс. белков, а ДНК в клетке хватает на 5 млн. Получается, что генетическая система клеток в высшей степени «бюрократична»: руководителей, т. е. регуляторных генов, там в тысячи раз больше, чем непосредственных исполнителей — структурных генов.
Иначе и быть не может. Человек при соответствующей подготовке может прочесть и понять любую книгу, написанную другим человеком: ведь его мозг — система несравненно более сложная, чем отдельная книга. А генетическая программа клетки должна сама себя прочесть, понять и задать клетке определенный объем работ.
Только сейчас ученые начинают постигать хитроумнейшие детали этого механизма. Чтобы лучше понять его, привлечем аналогии и наглядные примеры. Представим, что мы получили по радио серию букв и цифр, соответствующих названию судна и географическим координатам его положения. Ну и что? Смысл сообщения остается неясен. Но если сообщению предшествуют серия из 12 тире плюс несколько раз повторенное сочетание — три точки, три тире, три точки (SOS), оно расшифровывается однозначно — это сигнал бедствия. Если терпящий бедствие призывает помощь по радиотелефону, он должен перед этим произнести несколько раз условное легкоразличимое на слух буквосочетание МЭЙДЭЙ («майский день» по-английски). Вот пример «регуляторной последовательности» — не из нуклеотидов, как в ДНК, а из точек и тире или звуков.
Рассуждая так, придем к выводу, что при каждом структурном гене должны быть последовательности, определяющие, когда, при каких условиях он должен быть транскрибирован, сколько актов транскрипции нужно сделать и когда он должен замолчать. Мало того, эти гены-регуляторы должны быть как-то связаны друг с другом. Только в этом случае клетки одного типа будут синтезировать один набор белков, клетки другого — другой и одна превратится, например, в эритроцит, другая в нейрон — клетку нервной системы.
Теперь посмотрим, что известно на сегодня о регуляторных элементах генов и генах-регуляторах.
Больше всего удалось узнать о регуляторных участках ДНК, расположенных непосредственно перед нуклеотидными последовательностями, кодирующими ту или {31} иную полипептидную цепь белка. У них две обязанности. Во-первых, здесь находится последовательность-сигнал, показывающая, где необходимо связаться РНК-полимеразе, чтобы начать транскрипцию данного гена. Ее называют промотором. Во-вторых, в этом же участке ДНК расположены нуклеотидные последовательности, которые участвуют в регуляции уровня транскрипции: с одними из них связываются белки, усиливающие синтез иРНК на ДНК (белки-активаторы), а с другими, называемыми операторами, белки-репрессоры, которые подавляют транскрипцию или вовсе ее останавливают. Ясно, что белки-активаторы и белки-репрессоры также должны быть закодированы в каких-то генах. Такими генами являются гены-регуляторы.
Чтобы нагляднее представить механизм действия, рассмотрим, как регулируется работа гена, в котором закодирован фермент β-галактозидаза у бактерии — кишечной палочки. Если бактерия синтезирует этот фермент, она может расти, потребляя в качестве единственного источника углерода углевод молочный сахар — лактозу. Обычный источник углерода для кишечной палочки — глюкоза. Лактоза — это дисахарид, она содержит остатки галактозы и глюкозы. Если вместо глюкозы «кормить» кишечную палочку лактозой, то в ней начинается синтез фермента Р-галактозидазы, выщепляющей из лактозы необходимую бактерии глюкозу. Обратите внимание, если глюкоза присутствует в питательной среде, то кишечная палочка Р-галактозидазы не образует. Она ей просто не нужна. На языке генетики это означает, что ген Р-галактозидазы репрессирован, т. е. «молчит». Но при замене глюкозы на лактозу он включается.
Впервые расшифровать события, которые здесь происходят, сумели французские ученые Ж. Моно и Ф. Жакоб. Они установили, что, когда кишечная палочка растет на глюкозе, промотор гена β-галактозидазы недоступен для РНК-полимеразы потому, что он заблокирован белком-репрессором, прочно связанным с оператором (рис. 13). Репрессор можно сравнить с пломбой на двери запечатанного помещения: эта пломба срывается в каких-то чрезвычайных обстоятельствах.
Заменим глюкозу на лактозу. Промотор гена β-галактозидазы свободен, и синтез иРНК на этом гене может начаться, так как репрессор теперь находится в неактивном состоянии. Что же с ним произошло?
| {32} |
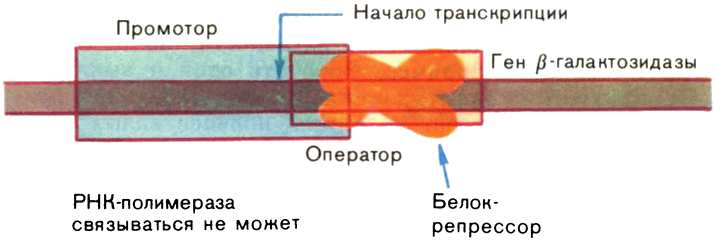 |
Рис. 13. Регуляция работы гена (ген β-галактозидазы репрессирован). |
Оказывается, новый источник углерода (равно как и многие другие соединения, похожие на лактозу) прочно связался с репрессором и сделал его неспособным взаимодействовать с оператором. Такие вещества называют индукторами. Более того, в отсутствие глюкозы в клетке начинает работать белок-активатор, который связывается с ДНК слева от РНК-полимеразы и помогает ей начать транскрипцию (рис. 14).
Такое состояние будет поддерживаться до тех пор, пока в среде есть индуктор. Любопытно, что кишечную палочку можно «обмануть»: подсунуть ей соединение, которое связывается с репрессором, но не расщепляется белком — продуктом репрессированного гена. Ген тогда работает вхолостую.
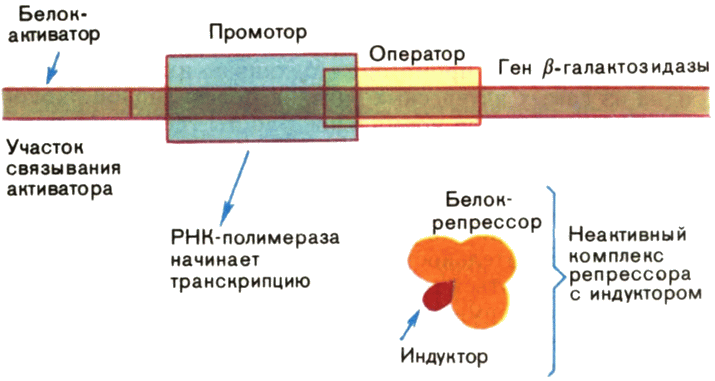 |
Рис. 14. Регуляция работы гена (ген β-галактозидазы активен). |
| {33} |
Схема Жакоба и Моно — один из самых простых способов регуляции генной активности, но далеко не единственный. Например, включать одни и выключать другие гены можно, изменяя саму РНК-полимеразу. Этот фермент состоит из многих полипептидных цепей, называемых субъединицами. Присутствие одной из таких субъединиц (называемой δ-фактором) абсолютно необходимо для того, чтобы РНК-полимераза связалась с промотором и начала транскрипцию. Изменяя δ-фактор, можно изменять сродство РНК-полимеразы к промоторам. Таким путем регулируются гены во время так называемого «теплового шока» — явления, широко распространенного в природе. Если любой живой организм (будь то бактерия или мушка-дрозофила) поместить в условия повышенной температуры (не смертельной, конечно, но при которой он себя чувствует неуютно), то организм будет приспосабливаться. Он в срочном порядке начинает в больших количествах синтезировать спасательные белки (или белки-спасатели). Уровень синтеза обычных белков при этом сильно снижается. В этом случае активизируются одни гены (гены «теплового шока») и подавляются другие гены. Оказалось, что, по крайней мере, у бактерий активация генов «теплового шока» связана с заменой старого δ-фактора на новый, приспособленный к промоторам этих генов.
Говоря о регуляторных элементах генов, нельзя не упомянуть еще о нескольких. Во-первых, недавно в хромосомах были найдены участки — усилители транскрипции, которые расположены на большом (иногда очень большом) расстоянии от кодирующей последовательности гена и его промотора. Механизм их действия — одна из самых интересных загадок молекулярной биологии. Во-вторых, для нормальной работы гена очень важны участки, расположенные в конце кодирующей последовательности и служащие сигналом остановки транскрипции. Их называют терминаторами. В некоторых генах можно обнаружить терминатор и внутри кодирующей последовательности. Такой ген может полностью транскрибироваться только в присутствии так называемого белка-антитерминатора, позволяющего РНК-полимеразе «проскочить» внутренний терминатор.
Теперь можно воссоздать достаточно точную картину расположения генетических регуляторных элементов, известных в настоящее время (рис. 15). Не следует
| {34} |
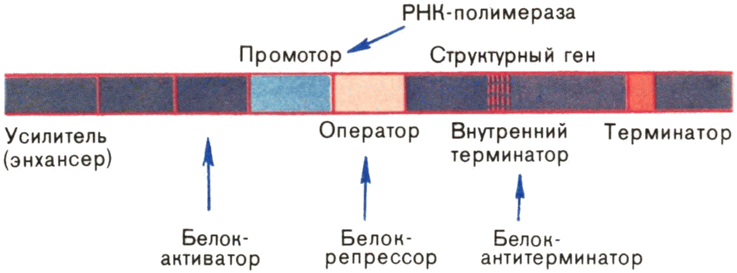 |
Рис. 15. Регуляторные элементы гена. |
забывать, однако, что многое и в организации генов, и в их регуляции еще предстоит выяснить в будущем, и эта схема еще будет существенно дополнена. Молекулярная биология очень молодая наука, и еще много открытий впереди. Посмотрите, например, как постоянно изменяется само понятие гена.
Так что же такое «ген»? Как мы уже рассказывали, классическая генетика пришла к представлению «один ген — один белок». Когда стало ясно, что гены построены из ДНК, появилось определение: ген — это линейный участок ДНК, в котором закодирован один белок.
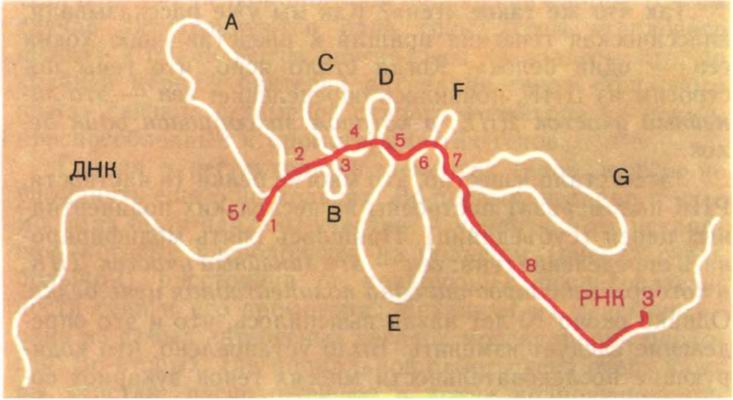
Затем стало известно, что многие белки (в частности, РНК-полимераза) построены из нескольких полипептидных цепей (субъединиц). Пришлось опять модифицировать определение гена: ген — это линейный участок ДНК, в котором закодирована одна полипептидная цепь белка. Однако около 10 лет назад выяснилось, что и это определение следует изменить. Было установлено, что кодирующие последовательности многих генов эукариот содержат вставки, которые к данному белку отношения не имеют. Эта особенность организации генов настолько важна и настолько широко распространена, что следует более подробно рассказать об этом. Такое открытие стало возможным, когда в руках ученых оказались, с одной стороны, индивидуальные гены, а с другой — индивидуальные иРНК для определенных белков. (В последующих главах мы расскажем, как этого можно достичь.) Вы знаете, что иРНК — это комплементарная копия гена. Каково же было удивление ученых, когда, получив ДНК—РНК-гибрид из денатурированной ДНК
| {35} |
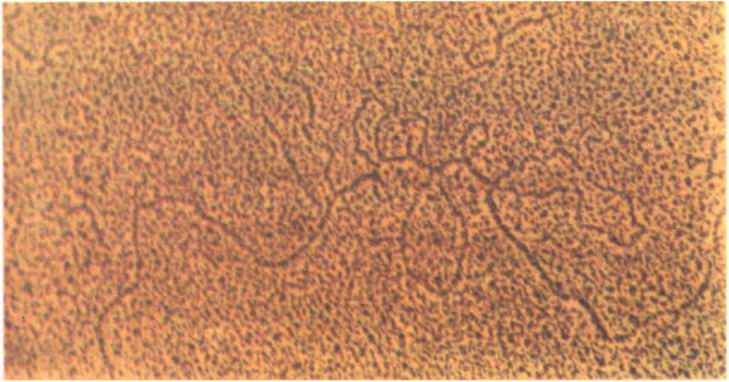 |
Рис. 16. Гибридизация гена белка овальбумина с иРНК этого белка. На микрофотографии показано, как гибрид (ДНК—РНК) выглядит под электронным микроскопом. Ниже приведена схема, объясняющая эту микрофотографию. |
 |
некоторых генов и транскриптов с них (иРНК), они увидели в электронный микроскоп такую картину (рис. 16). Протяженные участки ДНК (здесь они выглядят как петли) вообще не гибридизовались с РНК! Но ведь именно эта иРНК транслировала и давала полноценный белок. Более того, ее выделили из комплекса с рибосомами во время трансляции. Здесь вспомнили, что транслируемая иРНК обычно образуется из более длинного предшественника — пре-иРНК. Если с геном сгибридизировать
| {36} |
 |
Рис. 17. Гибрид гена овальбумина с предшественником иРНК |
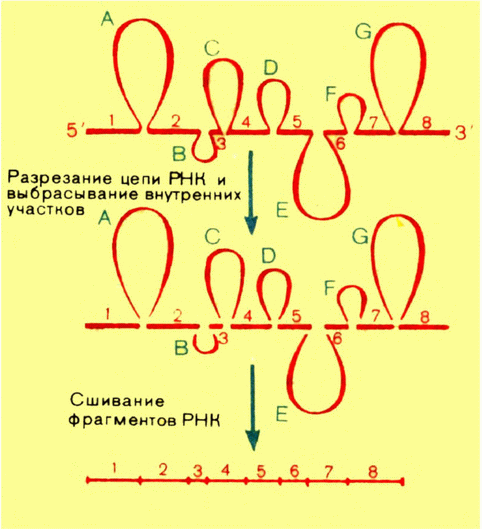 |
Рис. 18. Схема сплайсинга иРНК гена овальбумина. Цифрами обозначены кодирующие последовательности — экзоны, буквами — некодирующие вставки — интроны |
такой предшественник, то гибрид выглядит нормально (рис. 17).
Значит, в процессе превращения пре-иРНК в иРНК из его цепи исчезли какие-то внутренние участки. Это можно сделать, только разрезав цепь в определенных местах, удалив эти участки и вновь сшив оставшиеся районы РНК, совокупность которых кодирует данную полипептидную цепь (рис. 18). Этот процесс называют сплайсингом (от английского слова, попавшего в русский
| {37} |
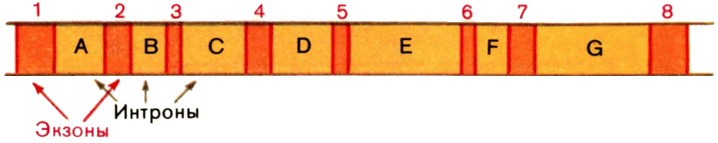 |
Рис. 19. Схема строения гена овальбумина. Цифрами обозначены кодирующие последовательности — экзоны, гибридизирующие с иРНК. Буквами обозначены некодирующие вставки — интроны, которые образуют петли (см. рис. 16). |
язык через морской жаргон: «сплеснивать» конец значит сращивать канат, веревку из отдельных кусков). Ведь когда внутренние участки вырезаны, остающиеся должны быть каким-то образом соединены в единую последовательность.
Отсюда ясно, что сам ген устроен так (рис. 19). Кодирующие участки гена обычно называют экзонами, некодирующие вставки — интронами. По размерам интроны варьируют от нескольких единиц до нескольких тысяч нуклеотидных остатков. Ген с интронами напоминает предложение на одном из языков, вроде эскимосского, в которых одно слово вторгается в другое, а целая фраза выглядит очень длинным словом.
И вновь видоизменяют определение гена: ген — это совокупность участков ДНК, кодирующих одну полипептидную цепь белка. Но этого мало: существуют и гены транспортных и рибосомных РНК, не кодирующие белков. А последовательности-усилители — гены это или нет? Ведь мутация не только в гене, кодирующем белке, но и в усилителе или промоторе, интроне или терминаторе может изменять, как это показано, общий облик и физиологию организма, его фенотип. Это изменение передается по наследству, а ведь наследственность, как мы знаем, — функция генов. Может быть, правильнее такая обтекаемая формулировка: ген — нуклеотидная последовательность, выполняющая определенную функцию?
Каким же образом гигантские по длине полинуклеотидные цепи ДНК организованы в клеточном ядре?
Главная черта этой организации — необычайная компактность ДНК. Рассмотрим простейшую систему — ДНК-содержащий вирус, например аденовирус, который вызывает ОРЗ (острое респираторное заболевание, или обычную простуду). Если частицу этого вируса {38} рассматривать как шарик, т. е. диаметр составляет всего 0,07 мкм, ДНК же аденовируса имеет длину 11 мкм.
Еще более удивительным выглядит сравнение размеров клеточного ядра клетки человека и его ДНК. Если мысленно ДНК, содержащуюся во всех 46 хромосомах человеческой клетки, соединить в одну нить, то ее длина будет равна 1,8 м! (Не забывайте, что диаметр такой нити всего 20 десятимиллиардных долей метра; представьте провод от Земли до Луны диаметром в 4 мм.) Диаметр же клеточного ядра всего примерно 6 мкм.
Но каждая хромосома — это не только ДНК. В хромосомах содержится множество различных белков. Главные из них — гистоны. Именно они помогают ДНК сложиться в столь компактные образования, что их можно уместить в такой маленький объем.
Гистоны — основные белки: они содержат очень много лизина, аргинина и гистидина с основными аминогруппами. Поэтому они легко и прочно связываются с ДНК — ведь это кислота. Сами по себе гистоны объединяются в комплексы, имеющие цилиндрическую форму. На эти цилиндрики (как на катушку) и накручивается ДНК (примерно по два витка на каждом гистоновом комплексе). Поэтому, если хромосому развернуть в нитку, то в электронном микроскопе она выглядит как бусы. Каждая бусинка — комплекс гистонов с накрученной на него ДНК. Нитки между бусинками — свободные от белка участки ДНК. Бусинки назвали нуклеосомами.
В развернутом виде нуклеосомная нить существует только в искусственных условиях. В хромосоме отдельные нуклеосомы объединяются по шесть или восемь штук и образуют тяжи, которые, в свою очередь, перекручены друг с другом в более толстые тяжи, и так до тех пор, пока не возникнет огромная хромосомная структура.
Вот таким образом и удается спрятать длинную ДНК в очень малый объем. Правда, упакованные таким образом гены неактивны. РНК-полимераза, к примеру, к ним просто не может пробраться. Поэтому перед началом работы генов целая область хромосомы, в которой они находятся, раскручивается и переходит на более низкий уровень организации. В этом процессе заключен еще один способ регуляции активности генов: в клетке могут включаться и выключаться целые группы генов в зависимости от того, в какого типа хромосомной структуре они находятся. {39}
Мы дали очень упрощенную картину сегодняшних знаний о структуре гена — ровно столько, чтобы можно было понять принципы генной инженерии. Но уже из нее становится ясно, в какое сложное устройство приходится вторгаться, чтобы направленно изменить наследственность. Ген, как смерть Кощея Бессмертного, запрятан в чрезвычайно сложной структуре за оболочкой ядра; очень непросто его оттуда извлечь, отделить от других генов и вставить в другой геном, так чтобы он работал в новом месте.
Выделять ДНК в чистом виде научились давно. Но в растворе эти длиннейшие молекулы представляют собой хаотическую смесь обломков, которую тепловое движение все время перебалтывает.
Представьте содержание большой книги (например, однотомника собрания сочинений Пушкина), напечатанное точками и тире на телеграфной ленте. Тираж, скажем 1 млн. экземпляров, собран в стог, который непрерывно ворошат. Телеграфные ленты при этом рвутся в случайных местах. Требуется дистанционно с большого расстояния взять оттуда ленту, на которой отпечатано стихотворение «Анчар» или поэма «Полтава» (примерно такое соотношение между длинами самого маленького и самого большого гена).
Перед будущими генными инженерами встала задача огромной сложности: ведь первичные структуры, т. е. последовательности нуклеотидов в генах, были практически неизвестны. Зная генетический код, можно было приблизительно, с учетом вырожденности кода, прогнозировать последовательности структурных генов, тех самых, которые кодируют белки. Однако узнать последовательность нуклеотидов в промоторах или усилителях стало возможным лишь тогда, когда их научились выделять. Образно говоря, уже проделав операцию по извлечению нужной телеграфной ленты из целого стога, не только не видя ее, но и не зная азбуки Морзе!
Еще недавно такая задача казалась, если и разрешимой, то в очень отдаленном будущем, и это заманчивое будущее отодвигалось с каждым новым открытием. Похоже, подтверждалась древняя грустная мудрость: «Во многом знании много печали». Но внезапно наступил перелом. Помощь пришла из, казалось бы, узкой специальной отрасли — генетики фагов — вирусов микроорганизмов и генетики самих бактерий.
| {40} |
В 40-x годах нашего столетия полагали, что у микроорганизмов — прокариот, не имеющих оформленного ядра, нет полового процесса, нет и обмена генами. Однако опыты Ф. Гриффитса и Л. А. Зильбера свидетельствовали, что обмен генами у прокариот все-таки должен существовать.
Невидимые хромосомы бактерий. Сейчас известно по меньшей мере три формы обмена генами — рекомбинации у бактерий. Первый из них назвали трансформацией (превращением); Именно его обнаружил Ф. Гриффите. Трансформация происходит, когда ДНК из разрушенных клеток одной бактерии попадает в способные делиться клетки другой.
Названный процесс в природе встречается не так уж часто. Прежде всего далеко не все клетки в культуре бактерий способны к трансформации. Клетки, способные поглощать чужую ДНК, называют компетентными. Чтобы повысить процент компетентных клеток, нужно сохранить в целости молекулы фермента, на какое-то время открывающего оболочку бактерии для чужеродных генов. Для этого разработаны особые методы. Кроме того, чужая ДНК должна обладать определенным сродством к хозяйской ДНК; иначе включения в бактериальную хромосому не произойдет.
Впрочем, есть ли у безъядерных организмов хромосомы? Оказывается, есть. И о строении их узнали до того, как увидели в электронном микроскопе. Началось с того, что в 1946 г. американские генетики Дж. Ледерберг и Е. Тэтум открыли у бактерий процесс, удивительно похожий на половой процесс у ядерных одноклеточных {41} — инфузорий, у которых он называется конъюгацией (соединением). Так, инфузории-туфельки соединяются попарно мостиками из цитоплазмы. Через эти мостики происходит обмен ядрами, а затем клетки расходятся. Следует отметить, что в этом случае привычное понятие «половое размножение» неточно. Это только у организмов, образующих гаплоидные гаметы, половой процесс (обмен генами) объединен с размножением. У инфузорий он отделен от размножения, обмен генами (рекомбинация) существует в чистом виде. Ведь после конъюгации остаются те же две инфузории, которые начали ее, но это рекомбинанты, обменявшиеся ядерным материалом.
Конъюгация у бактерий похожа на половой процесс инфузорий, пожалуй, только внешне. Прежде всего обмена генами здесь не происходит, передача ДНК односторонняя. Те клетки, которые отдают ДНК, называют донорами — «мужскими клетками». «Женские», акцепторные, клетки могут ДНК только принимать (рис. 20). Нить ДНК медленно, около полутора часов, перетекает из одной бактерии в другую по соединяющей их трубочке. Этот процесс можно в любой момент прервать, сильно встряхивая взвесь бактерий. Тогда соединяющая трубочка разорвется и в акцепторную клетку перейдет лишь фрагмент ДНК. Зная, с какой части бактериальной хромосомы начинается перенос, можно определить порядок расположения в ней генов.
По каким признакам генетики опознавали бактериальные гены? Чаще всего по способности бактерий синтезировать разные химические вещества, например аминокислоты. Обычный объект таких опытов бактерия кишечная палочка — Echerichia coli. Она может расти и в природных средах, но больше всего ее в кишечнике человека и в его экскрементах. Она постоянный спутник человека и свидетель загрязнения воды, почвы и пищевых продуктов.
Микробиологи, изучавшие бактерий недавно найденного в Магаданской области замороженного мамонтенка Димы, были очень огорчены: во всех посевах проросла вездесущая кишечная палочка. Удивляться нечему: перед появлением микробиологов мамонтенка смотреть сбежался весь поселок и не у всех руки были чистые.
Обычные, «дикие», штаммы кишечной палочки неприхотливы. Для них пригодна среда с глюкозой (источник
| {42} |
 |
Рис. 20. Клетки кишечной палочки в момент конъюгации. Хорошо видны трубочки, по которым ДНК перетекает из клетки в клетку (с электронной микрофотографии). |
углерода и энергии), фосфатом (источник фосфора) и какой-либо солью аммония (источник азота). Все аминокислоты и нуклеотиды они синтезируют сами. Это организмы-прототрофы. Близкой родственнице Е. Coli Clebsiella не нужен даже аммоний: в бескислородной среде кишечника она может синтезировать его из молекулярного азота атмосферы (в тканях человека и содержимом кишечника немало растворенного N2).
Из этих «диких» штаммов генетики вывели «капризные» штаммы, которые не могут синтезировать необходимые им вещества из аминокислот или витаминов; чтобы они росли, в среду следует добавлять нужное соединение. Такие мутанты-«неженки» называют ауксотрофами. Исследуя их, можно установить, сколько генов участвует в синтезе какого-либо соединения (синтез гистидина, например, контролируют десять генов).
Не менее важные признаки — устойчивость к антибиотикам, способность использовать в качестве источника энергии разные вещества, подвижность, патогенность, наконец, форма колонии на твердой среде.
Поставим такой опыт. Проведем конъюгацию клеток {43} двух штаммов: ауксотрофного (акцептор) и «дикого», прототрофного (донор). Получив от донора неповрежденный ген, клетка акцептора вновь обретает утерянную способность, в частности, сбраживать молочный сахар-лактозу. Ограничив время конъюгации, можно довольно точно определить, в каком месте хромосомы этот ген находится (за единицу расстояния обычно принимают 1 минуту времени вхождения «мужской» хромосомы в «женскую»). Сейчас длину генов измеряют в тысячах нуклеотидных пар ДНК.
Так построили первые карты бактериальных хромосом. Оказалось, что единственная бактериальная хромосома не имеет ни начала, ни конца. Это замкнутая, кольцевая молекула ДНК с длиной окружности около 0,2 см (естественно, это кольцо многократно скручено: иначе оно просто не уместится в клетке микронных размеров).
На рисунке 21 дан фрагмент генетической карты хромосомы кишечной палочки штамма К12, полученной одной из первых. Символами показаны разные гены: Arg A — первый по счету ген, обусловливающий способность к синтезу аргинина; Ага — способность сбраживать углевод арабинозу; Sm — устойчивость к антибиотику стрептомицину и т. д.
Зададимся вопросом: что определяет «пол» у бактерий, почему одна из них оказывается донором, а другая акцептором? У человека, например, мужской пол определяет Y-хромосома, вторая Х-хромосома в женском наборе остается неактивной. Нет ли чего похожего у конъюгирующих бактерий?
Оказалось, что не менее 90% всех известных штаммов кишечной палочки — акцепторы, остальные — доноры. Способность к донорству может исчезнуть, если подействовать на клетки донорского штамма ультрафиолетом или мутагенами, например акридиновыми красителями. Наконец, способность к донорству можно передать от клетки к клетке, превратить акцептора в донора. Следовательно, в донорских клетках есть какой-то материальный объект, содержащий ДНК (или состоящий из ДНК), который и отвечает за передачу генетической информации. Он образует мостик, по которому ДНК из одной клетки переходит в другую, может сам перейти по тому же мостику в клетку акцептора, придав ему донорские свойства, и может сам мутировать, как хромосома. Его
| {44} |
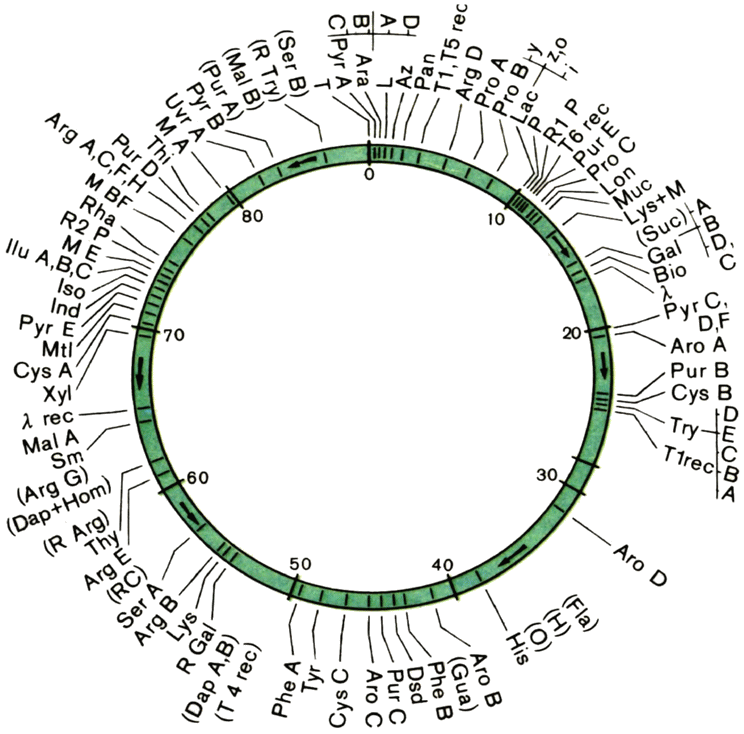 |
Рис. 21. Карта кольцевой хромосомы кишечной палочки. |
назвали фактором F. Казалось, это аналог Y-хромосомы у мужчин. Однако схожесть была лишь внешняя.
Чтобы понять, что такое фактор F, вернемся в 1915— 1917 гг., когда были открыты вирусы бактерий — бактериофаги (или просто фаги).
Бактерии и вирусы. В 1915 г. канадский француз Ф. Д.'Эррель обнаружил у саранчи заразное заболевание — понос, приводящий к гибели насекомого. Его вызывали бактерии — коккобациллы. Размножая вновь открытую бактерию на среде с твердым агаром, Д'Эррель столкнулся с любопытным явлением: во многих чашках Петри на поверхности агара, заросшей слоем бактерий, появлялись мелкие прозрачные пятна — места, в которых бактерии погибли (теперь их называют бляшками). {45} А в жидких средах культуры вдруг погибали, бактериальные клетки распадались, лизировались.
Такие случаи наблюдали и другие микробиологи, но лишь Д'Эррель догадался, что имеет дело с вирусом — паразитом бактерий и что он открыл паразита саранчи и паразита этого паразита! Он же первый предложил термин «бактериофаг» — пожиратель бактерий.
Очень быстро выяснилось, что фаги широко распространены. Д'Эррель обнаружил их у дизентерийной палочки, а потом их нашли практически у всех микроорганизмов, вызывающих самые разнообразные болезни — от чумы до скарлатины. Возникла идея фаговой терапии — лечение болезней фагами, имевшая большой успех в 20-х годах.
К огорчению врачей, оказалось, что многие фаги, убивая одни клетки бактерий, оставляют живыми другие клетки того же штамма, которые продолжают делать свое «черное» дело. Причина этого загадочного явления стала понятной лишь в конце 40-х годов благодаря блестящим работам знаменитого французского биохимика Андрэ Львова. А. Львов родился и вырос во Франции, но его родители русские. Отец ученого был политическим эмигрантом, осевшим во Франции до Октябрьской революции, а мать известна каждому из нас: она изображена на картине В. Серова «Девушка, освещенная солнцем».
Отметим, что бактериофаг — это ДНК (значительно реже встречаются РНК-содержащие фаги), заключенная в капсулу из белковых молекул. Попадая в бактерию (у сложных фагов есть очень хитроумные устройства, с помощью которых они «впрыскивают» в хозяйскую клетку свою ДНК; см. рис. 20), ДНК фага начинает «подрывную деятельность»: выключает синтез хозяйских белков, синтезирует свои иРНК; на них как на матрицах рибосомы хозяина синтезируют фаговые белки. Сама фаговая ДНК активно реплицируется в клетке-хозяине. ДНК фагов либо кольцевая, либо становится кольцевой, попадая в бактериальную клетку. Далее ДНК встраивается в фаговые частицы, которые в большом числе накапливаются в клетке-хозяине и в конце концов разрушают ее.
А. Львов установил, что в части клеток, заражаемых некоторыми фагами, фаговая ДНК не образует фаговых частиц, а вместо этого встраивается в хромосому {46} хозяина. Фаговая ДНК, или, как говорят, геном фага, реплицируется в составе хромосомы бактерии и вместе с ней передается из поколения в поколение. Встроенная фаговая ДНК направляет синтез только одного белка-репрессора, который не позволяет ей выйти из генома хозяина. Этот же белок не позволяет другим фаговым ДНК, попадающим в бактериальные клетки, хозяйничать в них. Таким образом, бактерии, в геном которых встроена фаговая ДНК, устойчивы (иммунны) к воздействию такого же фага, что и является зачастую причиной нечувствительности болезнетворных бактерий к бактериофагам. Это явление широко распространено в мире паразитов. Например, человек, имеющий в своем кишечнике солитера, не заражается его личинками повторно. Солитер всегда один — потому он и называется солитером («одиноким»).
Если же белок-репрессор разрушить (это происходит, в частности, при облучении клетки ультрафиолетовым светом), то фаговая ДНК выходит из генома хозяина и ведет себя в клетке так, словно попала в нее извне, т. е. в конце концов лизирует клетку. Фаги, способные встраиваться в геном хозяина, носят название лизогенных (их называют, кроме того, умеренными, так как они не всегда убивают клетку), а про клетку, которая в своем геноме несет такой фаг, говорят, что она находится в лизогенном состоянии.
Изучению умеренных фагов посвящено множество работ, и некоторые из них имеют самое непосредственное отношение к возникновению генной инженерии.
Чудесные ферменты — рестриктазы. Давно замечено, что наиболее детально исследованный из умеренных фагов — бактериофаг λ, паразитирующий в клетках штамма К кишечной палочки и выделенный после лизиса этих клеток, может лишь с очень низкой эффективностью заражать клетки другого штамма этой бактерии — штамма В. И только те немногие фаговые частицы, которые выжили в штамме В, охотно паразитировали в клетках этого штамма, но зато теряли способность заражать штамм К. Эти штаммы представляют собой два очень близких варианта кишечной палочки. Пытаясь выяснить причины столь странного поведения фага λ, ученые открыли чрезвычайно важное явление — рестрикцию-модификацию ДНК в клетках бактерий. Вот в чем суть названного явления. {47}
В клетках кишечной палочки постоянно образуются ферменты — эндонуклеазы, которые узнают в молекулах ДНК строго определенные последовательности и разрезают ее двойную спираль в этих местах. Позже мы расскажем более подробно, как это происходит. Эндонуклеазы (теперь они широко известны под названием эндонуклеаз рестрикции или просто рестриктаз) и разрушали ДНК фага А, в штамме В кишечной палочки. Но тогда возникают вопросы: что в штамме К вообще нет рестриктаз? Почему рестриктазы в штамме В не разрушают свою собственную ДНК, а заодно и ДНК фага, который на них паразитирует?
Оказалось, что в штамме К рестриктазы есть, но иные: они расщепляют ДНК по другим участкам. Более того, в клетках штамма К есть фермент, который модифицирует (метилирует, присоединяет метильную группу СН3) основание в участке ДНК, узнаваемом ретриктазой этого штамма, и делает его для нее недоступным, т. е., попросту говоря, защищает ее ДНК от своих рестриктаз. Вся ДНК, которая синтезируется в бактериальной клетке, подвергается защите уже в момент своего образования. Когда же в клетку попадает чужеродная незащищенная метилированием ДНК, рестриктазы расщепляют ее на куски, которые станут «жертвой» других, уже менее специфичных нуклеаз. И лишь те молекулы чужеродной ДНК, которые успевают модифицироваться ферментами модификации, могут в этих клетках функционировать. Вот почему небольшой части ДНК фага λ из штамма К удается спастись в штамме В. Их спасают «забежавшие вперед» ферменты — метилазы хозяйской клетки.
Сейчас известно уже несколько сотен различных рестриктаз из множества бактерий. Если вы внимательно ознакомитесь с рисунком 22, в котором приведены наиболее широко употребляемые рестриктазы, то увидите, что они отличаются друг от друга не только нуклеотидными последовательностями, по которым они расщепляют ДНК, но и по способу действия. Одни рестриктазы образуют однотяжевые участки длиной в четыре нуклеотидных остатка, другие — в два остатка, третьи разрезают ДНК так, что однотяжевых участков вообще не возникает. И самое важное: участки узнавания ДНК многими рестриктазами обладают симметрией второго порядка. Что это такое? Рассмотрим участок ДНК, узнаваемый
| {48} |
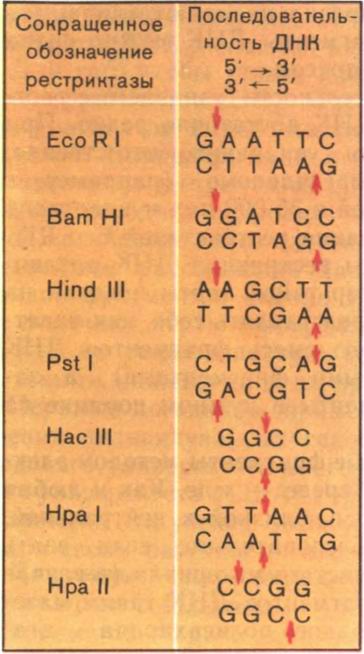 |
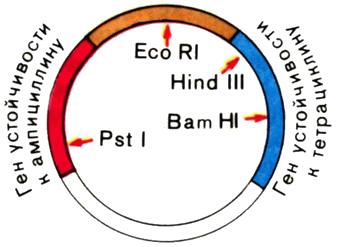 |
Рис. 22. Плазмида pBR 322. Показаны уникальные места разрезания ДНК рестриктазами. Слева приведена таблица наиболее широко применяемых рестриктаз и последовательности ДНК, ими расщепляемые (стрелками показаны места разрыва цепей). Сокращения рестриктаз даются по латинским названиям микроорганизмов, из которых выделена рестриктаза. Так, EcoRI означает: рестриктаза выделена из кишечной палочки (Ecsherichia coli) штамма R первой по счету. |
и разрезаемый одной из рестриктаз кишечной палочки, известной под названием Eco RI (см. рис. 22).
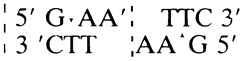
Если в центре этой шестичленной последовательности мысленно провести ось (перпендикулярно плоскости листа), а затем повернуть эту последовательность на 180° в плоскости чертежа, то получим ту же нуклеотидную последовательность. Иными словами, нуклеотидный текст, записанный в этой, последовательности, можно читать как слева направо, так и справа налево (помня только об асимметричности межнуклеотидных связей), и он будет одним и тем же. В лингвистике такие тексты называют перевертышами («А роза упала на лапу Азора»). И еще одна очень важная особенность разрыва, генерируемого в ДНК рестриктазами: образующиеся на концах однотяжевые последовательности ДНК комплементарны {49} друг другу; их образно называют «липкими» концами, с их помощью фрагменты ДНК можно снова соединить (слепить) друг с другом.
Нуклеотидные последовательности, узнаваемые рестриктазами, встречаются в ДНК достаточно редко. При этом шестичленные участки узнавания, естественно, встречаются реже, чем четырехчленные (например, в ДНК бактериофага Т7 длиной в 35 000 пар нуклеотидов нет ни одного участка узнавания рестриктазой Eco RI). Это позволяет строить карты рестрикции ДНК различных вирусов и фагов. Пример такой карты показан на рисунке 22. Нужно только представлять себе, как удается разделить такую сложную смесь фрагментов ДНК (называемых рестрикционными фрагментами), а затем расположить эти фрагменты в нужном порядке на карте.
Разделяют рестрикционные фрагменты методом электрофореза в студнеобразной среде — геле. Как и любая другая кислота, ДНК в среде, близкой к нейтральной, заряжена отрицательно. Следовательно, если взять пластинку, сделанную из пористого материала (в случае крупных рестрикционных фрагментов ДНК таким материалом служит гель из природного полисахарида — ага-розы), пропитанную раствором электролита, на один из концов пластинки нанести раствор ДНК, поместить эту пластинку между двумя электродами и приложить к ним разность потенциалов так, чтобы положительный электрод находился на удаленном от образца ДНК конце пластинки, то молекулы ДНК будут двигаться в направлении от катода к аноду (от – к +). Так как в процессе электрофореза макромолекулам ДНК приходится преодолевать сопротивление, которое создает полимерная сетка геля (образно говоря, протискиваться сквозь ячейки в сетке геля), то чем крупнее фрагмент ДНК, тем медленнее он будет двигаться. В конце концов все фрагменты ДНК распределятся на пластинке с агарозным гелем в соответствии с их длиной. Их можно увидеть, например, в виде яркосветящихся, флуоресцирующих в невидимом ультрафиолетовом свете полос, если в электролит перед электрофорезом добавить краситель бромистый этидий, который образует с ДНК флуоресцирующие комплексы. Изменяя в геле концентрацию агарозы, можно придавать ему разную плотность — от полужидкого до твердого, как мармелад (это лакомство как раз и {50} делают на основе агароз), и, следовательно, разделять фрагменты ДНК желаемой длины.
Для того чтобы узнать последовательность расположения фрагментов ДНК, надо изучить порядок появления фрагментов в ходе частичного расщепления рестриктазой. Например, если в простейшем случае ДНК расщепляется рестриктазой на три фрагмента — А, В и С, а при неполном гидролизе этой ДНК той же рестриктазой получается более длинный фрагмент, который при дальнейшем расщеплении дает фрагменты А и В, то порядок фрагментов именно такой, как на рисунке 22. Так получают карты генов, называемые рестрикционными. Как вы увидите дальше, они совершенно необходимы генным инженерам в их практической работе.
Первыми догадались применить рестриктазы для получения индивидуальных генов Стэнли Коен из Стэнфордского университета и его коллега из Калифорнийского университета (США) Герберт Бойер в 1972 г. К этому времени эти ученые были уже хорошо известны благодаря своим работам по плазмидам бактерий.
Плазмиды — дар природы генным инженерам и проклятие врачей. Плазмиды — кольцевые молекулы ДНК, размером от 2–3 до нескольких десятков тысяч пар оснований. Они существуют и реплицируются независимо от хромосомы бактерии, хотя и используют для этого тот же самый ферментативный аппарат клетки. Плазмиды, как и некоторые умеренные фаги, — одни из главных «героев» этой книги, а почему — вы скоро узнаете.
Многие плазмиды могут передаваться от одной бактерии к другой при конъюгации. Их называют трансмиссивными (трансмиссия — передача, перенос). У всех трансмиссивных плазмид имеются гены, отвечающие за синтез особого белка — пилина. Именно этот белок слагает трубочки (ворсинки — пили), по которым ДНК при конъюгации переходит из клетки в клетку. Но то же делает и половой фактор: F — фактор бактерий. Не плазмидой ли он является? Действительно, это трансмиссивная плазмида, специализирующаяся на переносе хозяйских генов. И «мужские» клетки-доноры — это просто клетки-акцепторы, зараженные такой плазмидой (теперь, кроме фактора F, описаны и другие плазмиды, оказывающие хозяевам такие же «услуги»).
Генетики быстро разобрались и в том, как происходит генетическая рекомбинация у бактерий при конъюгации. {51} Старая хромосома и новая, перетекшая в клетку через пилиновую трубочку, построенную фактором F, образуют комплекс — две нити ДНК соединяются гомологичными местами. Обычно гаплоидная, однохромосомная, клетка бактерии на какое-то время становится диплоидной. Далее происходит процесс, очень похожий на кроссинговер у высших, ядерных, организмов. Лежащие рядом хромосомы обмениваются генами и группами генов. А затем при делении клеток хромосомы расходятся, бактерии снова становятся гаплоидными — до очередной конъюгации.
Теперь перейдем к явлению трансдукции (переноса). Как вы помните, для передачи генетической информации у бактерий требуется или наличие лизированных клеток, т. е. свободной ДНК (трансформация), или физический контакт клеток при половом процессе. При трансдукции не требуется ни того ни другого.
Дж. Ледерберг, открывший «пол» у бактерий, поставил изящный опыт. Он взял U-образную трубку, оба колена которой разделялись фильтром из пористого стекла, — так называемую трубку Дэвиса. Микробиологи ее применяют, когда изучают действие веществ, выделяемых одним микробом на развитие другого. Ведь микробы не проходят через узкие поры, а молекулы их метаболитов проходят. Но через них проходят и фаги.
В одно колено трубки наливали культуру ауксотрофных бактерий, не способных синтезировать какую-либо аминокислоту, а в другое — культуру «диких», автотрофных (иногда штаммы двух ауксотрофов, но разных, с разными генетическими дефектами). В конце опыта ауксотрофы приобретали способность синтезировать эту аминокислоту! Может быть, протейная палочка в опыте Л. А. Зильбера таким же образом приобрела признак сыпнотифозной: ведь их разделяла полупроницаемая мембрана?
Основное условие успеха опыта: штаммы должны быть заражены лизогенным (умеренным) фагом. Фаги могут переносить генетическую информацию (гены) от одной хозяйской клетки к другой.
Бактерии вместо типичного полового процесса, свойственного эукариотам, разработали иные способы рекомбинаций, не менее эффективные. Вы скажете: все это, конечно, очень любопытно, но что нам до обмена {52} генов у бактерий, какое это может иметь практическое значение? Первостепенное, и примеры, которые мы приведем, убедят вас в этом.
Дифтерию сейчас научились успешно лечить, однако раньше она уносила немало жизней, особенно детских. Мало кто знает, что сама по себе дифтерийная палочка неопасна. Она вызывает лишь легкое ангино-подобное заболевание. Смертельно опасен лишь выделяемый ею яд — дифтерийный токсин, вызывающий общее отравление организма. Это токсин белковой природы, а ген, определяющий его синтез, находится в плазмиде дифтерийной палочки!
Другой не менее опасный для человека токсин — холерный, выделяемый холерным вибрионом. Описан случай вспышки холероподобного заболевания, при котором вибрионы не были обнаружены. Оказалось, что ген холерного токсина в результате трансдукции или трансформации попал в вездесущую кишечную палочку.
Когда в практику медицины вошли антибиотики, врачи были убеждены, что наступила золотая эра медицины, что все бактериальные болезни будут побеждены. Высказывались, в частности, утверждения, что в наши дни можно было бы вылечить Пушкина, тяжело раненного на дуэли. Сшить поврежденный пулей кишечник врачи могли и тогда, но смертельный сепсис (заражение крови) был бы неизбежен. Вот если бы в распоряжении врачей, лечивших Пушкина, имелся пенициллин! Увы, сейчас медики вряд ли будут утверждать так решительно. Бактерии приспосабливаются к антибиотикам так же легко, как и к фагам. Причина — жесточайший отбор устойчивых к антибиотику бактерий.
Задумались ли вы, почему плесневые грибки, бактерии и другие микроорганизмы синтезируют лекарства для человека? Оказалось, что антибиотики имеют много родственных соединений, участвующих в обмене веществ у микробов. Часто соединение, безвредное для одного микроорганизма, для другого ядовито — и обладатель его вытесняет из питательной среды конкурентов. Пенициллин открыл английский ученый А. Флеминг, подметивший, что вокруг колоний плесени рода Penicillium образуется стерильная, свободная от бактерий зона. Стенка клетки бактерий слагается из длинных {53} цепочек азотсодержащих полисахаридов — ацетилглюкозамина и ацетилмурамовой кислоты, сшитых короткими цепочками аминокислотных остатков — пептидами. В этих пептидах необычные формы аминокислот: глутаминовая кислота правая, а аланин и правый, и левый. Поэтому оболочки бактериальных клеток не расщепляются обычными ферментами — протеазами.
Пенициллин как раз блокирует рост этих пептидных мостиков, клеточная стенка не растягивается, и бактерия лопается. А так как пенициллин практически нетоксичен для эукариот, он и получил распространение как лекарство. Лишь те бактерии, которые в результате отбора тем же пенициллином «научились» расщеплять его, не боятся высоких концентраций антибиотика. Другие антибиотики действуют на бактерии по-иному; левомицетин, например, подавляет у них синтез белка; стрептомицин искажает течение белкового синтеза на рибосомах, в белок включаются не те аминокислоты, которые нужны, и продукт синтеза оказывается дефектным.
По-разному бактерии приспосабливаются к ним. Порой антибиотик не расщепляется, а модифицируется каким-нибудь ферментом — достаточно иногда присоединения или отщепления метильной группы, чтобы он потерял свои полезные для человека свойства. При чем же тут плазмиды? — спросите вы. Дело в том, что гены, кодирующие ферменты, расщепляющие или модифицирующие антибиотики (пенициллин и тетрациклин, стрептомицин и левомицитин), могут переноситься от бактерии к бактерии вирусами и плазмидами. Устойчивость к антибиотикам может передаваться в мире микробов, не считаясь с видовыми границами. Ведь у кишечной и чумной палочки есть общие трансмиссивные плазмиды.
Мрачную известность получили в последнее время устойчивые ко многим антибиотикам штаммы золотистого стафилококка — причина многих послеоперационных осложнений. Единственное эффективное средство против него — антистафилококковый гаммаглобулин, т. е. антитело на оболочечные антигены этого микроба. К сожалению, пока он выделяется из донорской крови и потому малодоступен.
Мы привели лишь очень немногие факты, показывающие, {54} почему надо изучать взаимоотношения вирусов, плазмид и бактерий.
Встает вопрос: как выделять плазмидную ДНК в чистом виде? Несколько способов получения чистых плазмид уже разработано. Опишем самый распространенный.
Сначала во взвесь бактериальных клеток добавляют вещества, разрушающие их оболочки. Клетки разрушаются, лизируются, и ДНК переходит в раствор. Лизис виден невооруженным глазом: мутная легкоподвижная жидкость превращается в прозрачную, вязкую. Получается смесь бактериальной ДНК и плазмидной, но судьбы их разные. Кольцевые хромосомы бактерий огромны, и получить их целыми очень сложно: они ломаются на линейные фрагменты.
Иное дело — плазмидная ДНК или ДНК умеренных фагов. Ее кольца много меньше, чем у бактерий; у самых малых плазмид молекулярная масса всего около 2,5 млн. дальтон. К тому же они компактно уложены (суперскручены) и имеют все шансы сохраниться целыми. Как разделить смесь линейной ДНК бактерии и кольцевой (плазмиды)? Сейчас чаще всего используют центрифугирование в градиенте концентрации тяжелой соли, например хлористого цезия. В раствор ДНК добавляют CsCl и откручивают на центрифуге при высоких скоростях — до ускорения, в 105 тыс. превышающего нормальное земное. В таких условиях создается градиент концентрации CsCl, которая уменьшается от дна пробирки к поверхности. В этом градиенте молекулы ДНК всплывают или тонут, пока не остановятся в слое с равной плотностью. Так, воздушный шарик, заполненный водородом, взлетает к разреженным слоям атмосферы, пока не уравновесится. Нагрузите его побольше — он остановится на меньшей высоте, а то и не взлетит.
То же происходит и с молекулами. Тяжелая, плотная РНК «проваливается» на дно пробирки. Легкие белки образуют слой под мениском. А ДНК образует полосы, располагаясь слоями по удельной плотности.
Если бактериальная и плазмидная ДНК по этому признаку отличаются, разделить их легко. Если же не различаются, разделить смесь очень нелегко. На помощь приходит светящийся в ультрафиолетовых лучах краситель — бромистый этидий, или этидий бромид — {55} ЭБ. ЭБ встраивается в полинуклеотидные цепи между основаниями, несколько раздвигая их. Молекула нуклеиновой кислоты в комплексе с ЭБ удлиняется, а плотность ее уменьшается. Линейные фрагменты ДНК можно насыщать ЭБ до предела. Иное дело — кольцевые молекулы. Сначала они переходят из сверхскрученного состояния в правильное кольцо. Такое кольцо называют релаксированным. Релаксированная кольцевая ДНК неохотно связывается с ЭБ. Так возникает разница в удельных плотностях. В ультрафиолете через полупрозрачную стенку пластиковой пробирки видны две светящиеся оранжевым светом полоски: тонкий слой плазмидной ДНК и широкий — хромосомной. Каждую из них можно отсосать отдельно, проколов иглой шприца стенку пробирки. ЭБ хорошо отделяется от ДНК спиртом (ДНК выпадает в осадок, а ЭБ остается в растворе).
Это очень распространенный способ, хотя есть и другие. Он привлекателен еще и тем, что исследователь видит материал, с которым работает, невооруженным глазом, что бывает в молекулярной биологии и генной инженерии нечасто.
Раньше генетики предсказывали устройство плазмидных и фаговых ДНК только экспериментально, не видя их; теперь они могли видеть отдельные кольца в электронном микроскопе и работать с генами как с химическими веществами.
В свою очередь, генетика микроорганизмов принесла будущей генной инженерии неоценимый дар — селективные среды.
Селекция означает отбор. Иногда в популярной литературе можно встретить такое утверждение. Раньше, мол, генетики только отбирали случайные изменения генов, а мы теперь направленно тасуем гены, и отбор нам не нужен. Запомните: такое утверждение безграмотно. Наоборот, в генетике бактерий и генной инженерии понятие искусственного отбора обрело новую жизнь. Ведь все события, о которых мы рассказали в этой главе, будь то трансформация или трансдукция, происходят с низкой частотой. Как найти редкое генетическое событие? Только отобрав его из массы ненужных. А отбор эффективен, когда есть из чего отбирать. В массовой популяции можно обнаружить редчайший вариант. {56}
Обычная концентрация бактерий — миллион клеток в миллилитре. А отбор проводят селективные среды.
Первым селективную среду использовал С. Н. Виноградский в 1894 г. в поисках свободноживущего микроорганизма, усваивающего молекулярный атмосферный азот. Обычно микробиологи выращивают колонии бактерий и грибков на питательных средах, содержащих агар (азотсодержащий полисахарид, получаемый из водорослей) или желатину. Несколько капель материнской культуры размазывают шпателем по поверхности твердой среды и помещают в термостат. На тех местах, куда попали клетки, способные расти на такой среде, вырастают колонии, каждая из которых — потомство одной исходной клетки.
С. Н. Виноградский вместо агара или желатины применил гель кремниевой кислоты, иначе говоря, затвердевший силикатный клей Na2SiO3 с добавками сахаров и солей, но без азота. Поэтому любая колония, выросшая на такой среде, автоматически оказывалась азот-фиксирующей: ведь необходимый для жизни азот она могла получить только из воздуха.
Метод селективных сред оказался очень эффективным. Продемонстрируем лишь несколько примеров его успешного применения.
Дана задача: из многих миллиардов клеток «дикой», автотрофной бактерии отобрать те, которые потеряли способность синтезировать незаменимую аминокислоту гистидин. С этой целью культуру бактерий выращивают в жидкой среде без гистидина, но с высокой концентрацией антибиотика пенициллина. Те клетки, которым гистидин не нужен, начинают расти: тут же оболочки их лопаются и бактерии погибают. Ведь пенициллин останавливает рост их оболочек, и увеличивающаяся в объеме цитоплазма разрывает клетку. Нуждающиеся в гистидине ауксотрофы остаются живы — они без него не растут. Остается осадить культуру в центрифуге, отмыть от пенициллина чистой средой и пересеять на твердую среду, содержащую гистидин. Таким способом можно отобрать одну нужную бактерию из сотен миллионов и за сутки получить от нее многомиллионное потомство.
Еще проще получить выращиванием на агаре с антибиотиком культуру бактерий, к этому антибиотику устойчивых. Когда в Японии обнаружили возбудителя {57} ангины, устойчивого к стрептомицину, генетики бактерий, заинтересовавшись этим фактом, получили штаммы ангинового стрептококка, для роста которых стрептомицин был необходим. Так у Стругацких («Понедельник начинается в субботу») Модест Матвеевич Камноедов, борясь с нетопырями в вестибюле института, вывел породу, питающуюся пиретрумом, смешанным с хлорофосом.
Работа с плазмидами очень облегчается тем, что многие из них содержат гены, обеспечивающие хозяйским клеткам устойчивость к антибиотикам. Раньше их называли R-факторами (от английского resistance — устойчивость). Допустим, нам нужно заразить какую-нибудь культуру плазмидой и отобрать зараженные клетки. Проинкубируем взвесь нужных бактерий с этой плазмидной ДНК и сделаем посев на селективной среде с антибиотиками. Известно, что плазмида имеет ген устойчивости. Значит, только зараженные ею клетки прорастут в колонии на ядовитом агаре, остальные погибнут.
Некоторые плазмиды содержат гены таких ферментов, которые позволяют хозяйским клеткам усваивать в качестве источника вещества и энергии новый, непривычный субстрат, например фенол или нефтяные углеводороды. Генетики микроорганизмов недавно вывели любопытный штамм бактерии из рода Псевдомонас. Клетки его содержат сразу несколько таких плазмид, что им позволяет усваивать все основные компоненты нефтяного загрязнения. Этой бактерии придается важное значение в охране окружающей среды.
Успехи практического применения генетики микробов стали особенно значительными в последние 30 лет. У многих людей стали возникать заманчивые идеи, суть которых можно свести к следующему. Пока генетическая рекомбинация у бактерий приносит человеку больше вреда, чем пользы. Достаточно вспомнить устойчивость к антибиотикам, которая в мире микробов распространяется как эпидемия. Но теперь, когда мы знаем механизм действия плазмид умеренных фагов, что мешает заставить бактерию, ту же кишечную палочку, синтезировать в культуре нужный нам белок, например какой-нибудь человеческий гормон или фермент? {58}
Уже есть система для переноса кусочка ДНК в клетку — плазмида или умеренный вирус. Эти трансмиссивные кольцевые молекулы ДНК назвали векторами. Есть фермент, который «пришьет» нужный ген к молекуле-вектору (ДНК-лигаза). И пусть этот акт переноса генетической информации происходит с ничтожной частотой — волшебные селективные среды позволяют нам его выявить. Остается научиться получать фрагменты ДНК с нужной нуклеотидной последовательностью. И тут С. Коен и Г. Бойер, о которых мы уже говорили, одни из первых вспомнили о рестриктазах. Именно эти ферменты, расщепляющие ДНК в заданном месте, проложили последний участок дороги, ведущий к власти над геном.
| {59} |
Разрезать и склеивать гены помогают ферменты. В наши дни идея С. Коена и Г. Бойера выглядит очень простой. Разрежем плазмиду одной из рестриктаз, образующих у фрагмента ДНК однотяжевые («липкие») концы. Той же рестриктазой разрежем на фрагменты ДНК, в одном из которых содержится интересующий нас ген. Если смешать эти фрагменты с разрезанной плазмидой, то с некоторой вероятностью они склеятся с плазмидой благодаря «липким» (комплементарным) концам. Далее чужеродную ДНК ковалентно пришивают к вектору ДНК-лигазой. В итоге получается созданная по заранее разработанному плану рекомбинантная ДНК, а весь план этого замечательного эксперимента умещается на небольшом чертеже (рис. 23).
Следующий шаг к схеме Коена — Бойера заключался в переносе рекомбинантной плазмиды в бактериальную клетку: только в клетке она может размножиться. Более того, как видно из рисунка, наряду с рекомбинантными ДНК в опыте Коена — Бойера всегда будет восстанавливаться (замыкаться) исходный вектор. И только после переноса в клетку эти молекулы ДНК можно легко отличить друг от друга. В то же время все подходящие на роль вектора плазмиды, которыми располагали С. Коен и Г. Бойер, оказались нетрансмиссивными, т. е. неспособными переходить из клетки в клетку. Тогда ученые предложили простую процедуру переноса плазмид в бактериальные клетки: клетки необходимо предварительно обработать хлористым кальцием.
| {60} |
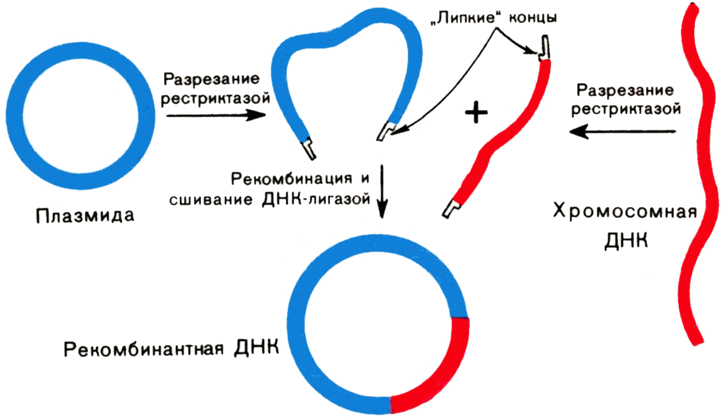 |
Рис. 23. Схема получения рекомбинантной ДНК по Коену — Бойеру. |
Теперь С. Коен и Г. Боейр могли приступить к экспериментальной проверке своей идеи. В их коллекции оказалась пара плазмид, у которых было всего по одному участку узнавания рестриктазой, — Eco RI. К тому же эти плазмиды несли гены устойчивости к разным антибиотикам: одна — к тетрациклину, а другая — к канамицину.
Эксперимент был осуществлен по приведенной выше схеме. Полученные плазмиды перенесли в бактериальные клетки (использовали специальный штамм кишечной палочки, лишенный тех рестриктаз, которые могли бы разрушить вектор) и высеяли на среду, содержавшую оба антибиотика. Ни исходная культура, ни клетки, в которые попали исходные векторы, на такой среде расти не могли. Росли на ней клетки, получившие гены устойчивости к обоим антибиотикам, т. е. содержавшие рекомбинантную плазмиду. Впервые по заранее разработанному плану удалось сконструировать ДНК с заданными свойствами. Работа С. Коена и Г. Бойера напоминала конструкторскую разработку, да и оперировали они рестрикционными картами плазмид, а их можно сравнить с чертежами, которыми пользуется инженер-конструктор. Генетика вступила в новую эру — эру генной инженерии! {61}
Если строго следовать историческому ходу научных событий, нужно признать, что еще за год до С. Коена и Г. Бойера в том же Стэнфордском университете (недаром его называют родиной генной инженерии) П. Лобан и П. Берг первыми получили рекомбинантные ДНК, встроив в вектор фрагменты чужеродной ДНК. Однако схема их экспериментов была иной.
На концы векторной молекулы (в виде линейной ДНК) с помощью специального фермента терминальной (концевой) нуклеотидтрансферазы нарастили короткие полинуклеотидные последовательности, состоящие из одного и того же нуклеотида — А (такие последовательности, в данном случае поли-А, называют гомополинуклеотидными):
АААА векторная ДНК АААА
Концы фрагментов ДНК, среди которых был и фрагмент, содержавший искомый ген, таким же способом нарастили, но уже полинуклеотидом, комплементарным поли-А, т. е. поли-Т-последовательностями.
Дальше, смешав вектор с фрагментами, ученые получили их гибрид — рекомбинантную ДНК вследствие комплементарного спаривания поли-А и поли-Т-последовательностей. Затем фрагмент ДНК и вектор сшили ДНК-лигазой (рис. 24).
Недостаток такого подхода очевиден: П. Лобан и П. Берг использовали фрагменты ДНК, полученные при ее расщеплении случайным образом. Тем не менее их метод нашел дальнейшее развитие: во многих случаях оказалось удобным, расщепив рестриктазами вектор и ДНК с искомым геном, наращивать полученные концы комплементарными последовательностями. В 1980 г. П. Берг был одним из тех, кто получил Нобелевскую премию за работы, приведшие к созданию генной инженерии. П. Лобан же, завершив свою работу, вообще покинул биологию. Почему это произошло, мы расскажем в конце этой главы.
Векторы. Рассмотрим векторные системы, которыми пользуются современные генные инженеры. Сформулируем требования, которым должны удовлетворять векторные молекулы ДНК:
— они должны обладать способностью реплицироваться (размножаться) в клетке-реципиенте; для этого в вектор вводят специальный участок, с которого
| {62} |
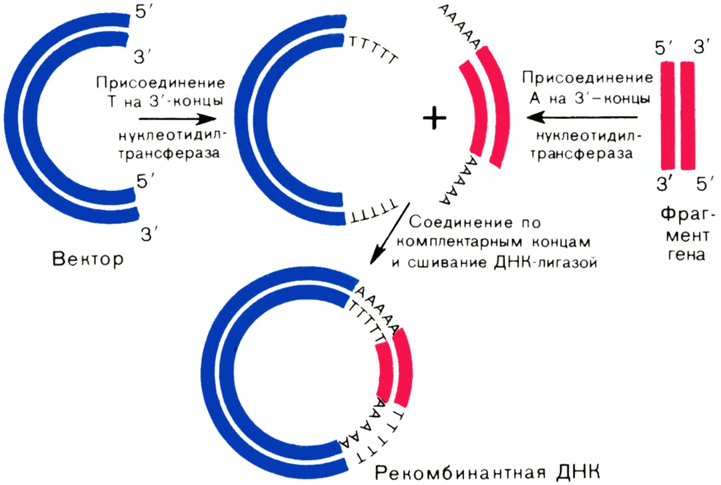 |
Рис. 24. Конструирование рекомбинантной ДНК по Лобану — Бергу. |
начинается репликация ДНК (в нем находятся нуклеотидные последовательности, служащие сигналами начала репликации);
— они должны содержать один или несколько маркерных генов (от слова «маркировать» — метить, обозначать), которые придают клетке-реципиенту новые признаки, позволяющие отличить клетки с вектором от исходных клеток; этим признаком бывает устойчивость к какому-либо антибиотику;
— они должны содержать по одному или самое большее по два участка, разрезаемые той или иной рестриктазой; эти участки используются для встраивания в векторы чужеродной ДНК; поэтому они могут находиться в любых районах вектора (в том числе и в составе маркерного гена), но не в области, ответственной за начало репликации вектора (иначе после встраивания чужеродной ДНК этот участок будет «испорчен» и вектор не сможет размножаться в клетке).
Вы, вероятно, поняли, что плазмиды и ДНК бактериофагов — прекрасные кандидаты в векторы. Но пока еще только кандидаты, а не сами векторы. Первому требованию они удовлетворяют полностью (как вы {63} знаете, они прекрасно реплицируются в клетках независимо от хромосомы). Но для того чтобы они удовлетворяли второму и третьему требованию, над ними нужно еще поработать, довести до кондиции. Во-первых, ввести в них дополнительные маркерные гены (ДНК бактериофагов сама по себе, как правило, таких генов вообще не содержит). Во-вторых, природные плазмиды и фаговые ДНК порой содержат слишком много участков разрезания данной рестриктазой, к тому же в участках, ответственных за репликацию ДНК. Отмечаются случаи, когда, напротив, в ДНК нет нужного участка узнавания рестриктазой. Вот почему генный инженер перестраивает вектор.
Решить названные проблемы помогают те же рестриктазы и другие ферменты, применяемые для встраивания ДНК в векторы. Мы уже описали случай, когда слиянием двух плазмид, каждая из которых несла по одному гену устойчивости к антибиотику, был получен вектор с двумя маркерными генами. Кроме генов, делающих клетку устойчивой к воздействию антибиотика, используются и другие маркерные гены. Очень популярным оказался первый ген лактозного оперона кишечной палочки (см. главу 2), в котором закодирован фермент β-галактозидаза. Мы уже рассказывали, что этот фермент расщепляет дисахарид лактозу и ее аналоги. В качестве аналога можно взять вещество 5-бром-4-хлор-3-индолил-β-галактозид, которое генетики назвали Х-гал. β-Галактозидаза отщепляет от него бромхлориндол — краситель ярко-голубого цвета. Теперь представьте себе, что в клетку кишечной палочки (или какой-то другой бактерии), лишенной нормального гена β-галактозидазы, ввели вектор с этим геном. Если в твердую среду, на которой растут клетки, добавить «Х-гал», то клетки с вектором будут давать колонии, окрашенные в голубой цвет. Их очень легко отличить от исходных, бесцветных колоний.
На этом достоинства «голубого» вектора не кончаются: если встроить в векторный ген β-галактозидазы интересующий нас ген А, расчленив его на две части геном А, лишив возможности продуцировать активный фермент, и полученной рекомбинантной ДНК вновь трансформировать клетки кишечной палочки, то клетки с рекомбинантной ДНК дадут светлые колонии; их
| {64} |
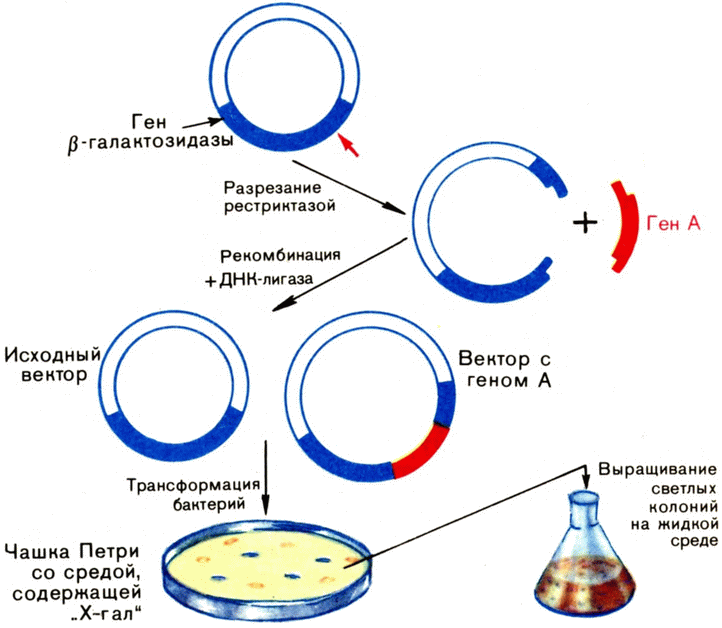 |
Рис. 25. Использование гена β-галактозидазы для клонирования генов. |
теперь легко отличить от клеток (голубых) с исходным вектором (рис. 25).
Лишние рестриктазные участки из векторов убирают с помощью делеций. Делеция — это удаление одной, нескольких или даже очень большого числа нуклеотидных пар (т. е. целого протяженного участка) из молекулы ДНК. Существует множество способов вызвать делецию, и задача уменьшения числа участков, разрезаемых рестриктазами, большой трудности не представляет.
А что делать, если в нужном районе вектора нет необходимого участка узнавания рестриктазой, дающей «липкие» концы? Для этого химическим синтезом получают короткий фрагмент ДНК, содержащий необходимую последовательность. Подбирают рестриктазу, которая разрезает вектор в нужном районе, и ДНК-лигазой вшивают туда синтетическую ДНК. Ее называют {65} линкером — связкой (от английского слова — связывать). Часто линкер делают таким, чтобы в нем содержались последовательности сразу для нескольких разных рестриктаз (его называют полилинкером).
Итак, вектор создан. В него встроены фрагменты ДНК, среди которых находится интересующий нас ген. Клетки, в которые попал вектор, теперь можно легко отличить от исходных клеток. Более того, в некоторых случаях можно отличить клетки с векторами, в которые встроены фрагменты ДНК (т. е. рекомбинантные ДНК), от клеток с исходным вектором.
«Библиотеки» генов. Важно иметь в виду, что генные инженеры векторами всегда трансформируют клетки так, чтобы в одну клетку попала только одна молекула вектора. Поэтому дальше речь пойдет о поиске в сложной популяции клеток с рекомбинантными ДНК одной клетки с нужным геном.
Рассмотрим конкретный пример.
Как только возникла генная инженерия, генетики поспешили осуществить свою давнюю мечту: иметь в распоряжении так называемые библиотеки генов различных организмов. В современном понимании «библиотека» генов (генотека) означает набор одинаковых векторов, в которые встроены фрагменты хромосом некоего организма, в совокупности представляющие весь геном этого организма.
Оказалось, что удобнее всего создавать такие библиотеки с помощью векторов, полученных из ДНК фага λ. Мы не напрасно в предыдущей главе подробно рассказали об этом умеренном фаге (его ДНК способна встраиваться в хромосому хозяйской клетки). Сначала в ДНК λ-фага выявили область, которую можно видоизменять и даже целиком заменять на совсем другую ДНК, не нарушая ее репликацию. Эта область расположена в центре линейной формы фаговой ДНК и составляет примерно треть длины всей молекулы. Затем из левой и правой частей фаговой ДНК удалили места, по которым действуют наиболее часто употребляемые рестриктазы. Например, из пяти мест для рестриктазы Есо RI было оставлено всего два, но таких, которые позволяют вырезать из ДНК центральный район. Теперь, соединив концы ДНК, получим ее циклическую форму. Вектор готов к работе.
Предположим, что перед нами стоит задача получить
| {66} |
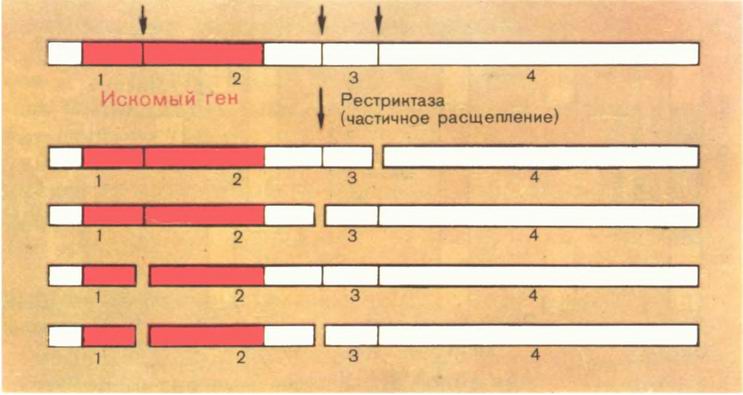 |
Рис. 26. Схема частичного расщепления ДНК с тремя участками, специфичными к рестриктазе (показаны стрелками). |
библиотеку генов мыши. Для этого нужно выделить суммарную ДНК из любого органа мыши, например из печени (обычно любая соматическая клетка несет весь набор генов данного организма, исключения редки), и обработать ее рестриктазой EcoRI в условиях частичного расщепления.
О том, что такое частичное расщепление, мы рассказали в главе 3. Почему именно частично, а не полностью следует расщеплять ДНК при получении «библиотеки» генов? Рассмотрим сегмент ДНК, в котором есть три места для рестриктазы EcoRI. Некий ген А может быть расположен в ДНК так, что один из рестриктазных разрывов расчленит его на две части. Следовательно, если полностью расщепить этот сегмент ДНК, то невозможно будет получить целый ген А. В условиях же частичного расщепления, когда образовываются, например, фрагменты 1—2, 2—3, 3—4, 1—2—3, 2—3—4, в двух фрагментах 1—2 и 1—2—3 этот ген сохранится полностью (рис. 26).
На следующем этапе из векторной ДНК фага X вырезают центральный район (разумеется, той же рестриктазой EcoRI) и смешивают ее с EcoRI — фрагментами ДНК мыши так, чтобы липкие концы склеились. Фрагменты сшивают с вектором и такими рекомбинантными ДНК трансформируют клетки кишечной палочки (в этом случае вместо термина «трансформация» обычно
| {67} |
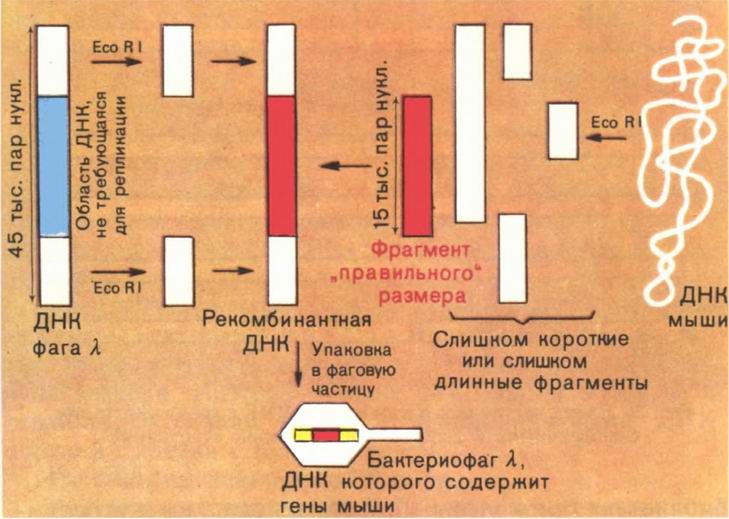 |
Рис. 27. Схема конструирования «библиотеки» генов мыши на базе бактериофага λ. |
употребляют термин «трансфекция» — гибрид трансформации и инфекции: ведь речь идет о заражении клетки геномом бактериофага).
Так проводят частичное расщепление ДНК мыши рестриктазой, то встроенные в ДНК фага λ фрагменты будут иметь самые различные размеры: от нескольких сот до нескольких десятков тысяч пар оснований. Выбрать из такого широкого набора фрагменты оптимальной длины такие, которые наверняка содержали бы неповрежденный ген и одновременно не были бы слишком большими (иначе их трудно будет анализировать), помогает сам бактериофаг λ. Как видно из рисунка 27, размер ДНК, которая попадает в фаговые частицы, не может быть произвольным: он не должен быть намного короче или заметно длиннее, чем ДНК обычного фага λ. Значит, если размер удаляемого из вектора центрального района составляет около 14 тыс. пар оснований, то примерно такую же длину будут иметь фрагменты чужеродной ДНК в фаговых частицах (чтобы общая длина рекомбинантного генома в них была равна примерно 45 тыс. пар оснований). {68}
Исходя из этого, можно рассчитать, сколько нужно иметь в «библиотеке» фаговых частиц, чтобы в ней с высокой вероятностью (~99%) был представлен весь геном мыши. Для генома млекопитающих, общая длина которого составляет ~3 · 109 пар оснований, эта величина составляет примерно 1 млн. фаговых частиц. Если нас интересует какой-то определенный ген, в этом миллионе нужно суметь найти одну частицу, в ДНК которой нужный ген встроен.
Как из миллионов генов выбрать единственный. Генные инженеры не оперируют с отдельными генами и отдельными фаговыми частицами. Они манипулируют с миллионными популяциями, преследуя цель выявить потом нужную комбинацию из ненужных.
Главное, что нужно иметь для такого поиска (теперь часто пользуются словом «скрининг»), это зонд — молекула РНК или ДНК (обязательно меченная радиоактивным изотопом, обычно фосфором 32Р), комплементарная нуклеотидной последовательности искомого гена.
Зонд можно синтезировать, если известна нуклеотидная последовательность (здесь надо вспомнить, что один ген отличается от другого прежде всего последовательностью нуклеотидных остатков) хотя бы небольшого участка гена или белка, который в нем закодирован. По аминокислотной последовательности с помощью генетического кода можно, казалось бы, легко воспроизвести нуклеотидную последовательность, ее кодирующую. Но нужно помнить, что код вырожден, и потому вместо одной последовательности получаются несколько ее вариантов. Поэтому из известной последовательности белка выбирают такой участок, где есть метионин и триптофан (у них только по одному кодону), и такие аминокислоты, для которых код вырожден в наименьшей степени. Если это сделать не удается, то приходится синтезировать серию зондов. Ведь вырожденность кода может привести к тому, что один и тот же аминокислотный текст оказывается закодированным в ДНК совершенно несходными нуклеотидными последовательностями. Например, сер-сер-сер-арг-ала в ДНК может читаться как AGTAGAGCACGA и как TCATCGTCTCGC.
Зондом может быть и РНК, выделенная тем или иным способом из клетки. Это зонд, который «дарит» генным инженерам сама природа: ведь иРНК комплементарна {69} гену. Часто оказывается полезным получить ДНК — копию (кДНК) этой иРНК с помощью образной транскриптазы.
Остановимся на операции получения ДНК-копий несколько подробнее: при клонировании генов к ней приходится прибегать не только для получения зондов, но и во многих других случаях.
Любая информационная РНК эукариот на 3'-конце содержит поли-А-последовательность — участок из нескольких десятков монотонно повторяющихся остатков адениловой кислоты. Эта последовательность не закодирована в ДНК, а присоединяется к иРНК после окончания ее синтеза с помощью специального фермента, напоминающего 3'-терминальную полинуклеотидтрансферазу. И хотя роль поли-А-последовательности в функционировании иРНК еще не вполне ясна (по некоторым данным, она делает иРНК устойчивой к нуклеазам цитоплазмы), ее присутствие именно на З'-конце этих молекул оказалось как никогда кстати.
Во-первых, с помощью поли-А-последовательности иРНК можно отделить от остальных клеточных РНК (рибосомных, транспортных и прочих, составляющих более 90% всей РНК клетки), у которых такой последовательности нет. Для этого раствор суммарной клеточной РНК пропускают через колонку, заполненную целлюлозой, с пришитым к ней полимером из тимидиловых Т-остатков. Информационные РНК связываются с носителем, а все другие РНК, не имеющие «хвоста» из поли-А, остаются в растворе. Колонку тщательно промывают растворителем, а затем связи А-Т разрушают нагреванием или повышением рН и вымывают фракцию иРНК.
Во-вторых, именно поли-А-последовательность на З'-конце иРНК позволяет легко получить ее ДНК-копию. Для этого поли-А-конец иРНК гибридизируют с олиго(Т)-затравкой (см. рис. 28) и с помощью обратной транскриптазы (ревертазы) на РНК как на матрице получают ДНК-нить. Далее уже с помощью обычной ДНК-полимеразы (после разрушения РНК-цепи) получают вторую цепь ДНК. В качестве затравки ДНК-полимераза использует образующуюся на 3'-конце первой ДНК-цепи шпильку, т. е. двуспиральный участок. Поэтому у двуцепочечной кДНК обе цепи оказываются связанными друг с другом. Их разрезают с помощью нуклеазы, специфичной к однотяжевой ДНК.
| {70} |
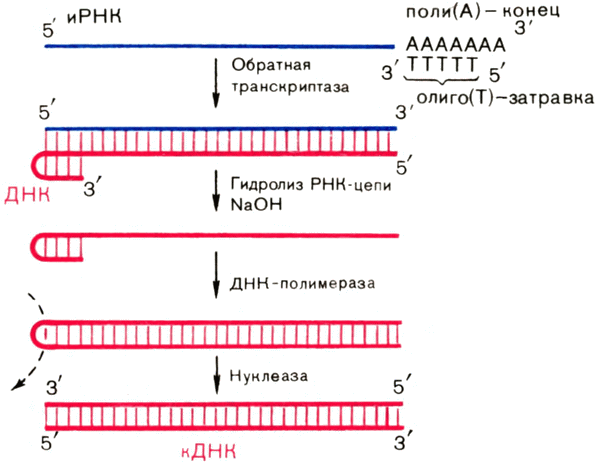 |
Рис. 28. Получение ДНК с помощью обратной транскриптазы. |
Обычно таким способом удается скопировать только часть иРНК (даже если обратная транскриптаза «прочтет» всю иРНК, часть кДНК будет потеряна при образовании шпильки). Однако в качестве зонда такая укороченная кДНК вполне пригодна.
Из очень небольшого количества иРНК можно получить большие количества кДНК-зонда. Для этого к кДНК пришивают линкерные участки, переносят ее в векторную плазмиду, которую размножают в соответствующих клетках в нужном количестве.
Имея зонд, можно приступать к анализу рекомбинантных фаговых частиц. Для этого бактерии, среди которых есть зараженные фагом, выращивают на твердой среде в чашках Петри, как говорят микробиологи, получают газон бактерий. В тех местах, где проявилась фаговая инфекция на газоне, будут наблюдаться прозрачные бляшки. Напомним, что в том месте, где образовалась бляшка, клетки кишечной палочки разрушены и вся ее площадь заполнена остатками клеток, фаговыми частицами и свободной ДНК бактериофага. Эта ДНК синтезировалась в клетке хозяина, но не успела одеться фаговыми белками. Именно за ней и пойдет охота. {71}
Давно замечено, что ДНК очень хорошо сорбируется на нитроцеллюлозе (бездымном порохе). Если из этого материала изготовить фильтр (похожий на обычный бумажный фильтр) и пропустить через него раствор ДНК, то ДНК задержится на фильтре так, словно была не в растворенном виде, а в виде осадка. Такие нитроцеллюлозные фильтры широко используют для поиска рекомбинантных ДНК с необходимыми генами.
Если нитроцеллюлозным фильтром прикоснуться к газону бактерий с бляшками, то молекулы ДНК как бы прилипнут к фильтру (сорбируются на нем). Необходимо с большой точностью отметить положение фильтра относительно газона (например, иглой проткнуть фильтр и находящийся под ним агар с газоном в нескольких местах). Далее фильтр быстро обрабатывают 0,5 н NaOH, затем нейтрализуют. Такая обработка приводит к тому, что цепи двуспиральной ДНК разделяются и она переходит в денатурированное состояние, в котором крепче связывается с нитроцеллюлозой. Остается только «навечно» закрепить такую ДНК на фильтре. Для этого фильтр вместе с ДНК прогревают при 80°С.
Отметьте, что положение зоны с молекулами ДНК на фильтре (маленькое пятнышко) точно соответствует положению определенной фаговой бляшки на газоне, т. е. на поверхности твердой среды с проросшими колониями.
Следующий шаг: обработка фильтра раствором радиоактивного зонда — полинуклеотида, комплементарного искомому гену. В основе этой процедуры лежит образование ДНК — ДНК или ДНК — РНК гибрида. Поэтому зонд должен быть в однотяжевой форме, а условия обработки оптимальными для гибридизации: повышенная температура (но не слишком высокая, чтобы образовавшиеся гибриды снова не разрушались), длительное время (чтобы зонд успел найти свою ДНК). По окончании процедуры гибридизации фильтр отмывают от избытка зонда (иначе лишняя кДНК или иРНК, «прилипнув» к фильтру, образуют сильный радиоактивный фон, скрывающий результаты). Теперь та ДНК, в которой находится искомый ген, связавшись с зондом, несет на себе метку в виде радиоактивного фосфата. Выявить положение ее зоны сравнительно просто: фильтр в темноте накладывают на обычную рентгеновскую фотопленку, после необходимой экспозиции (ее время
| {72} |
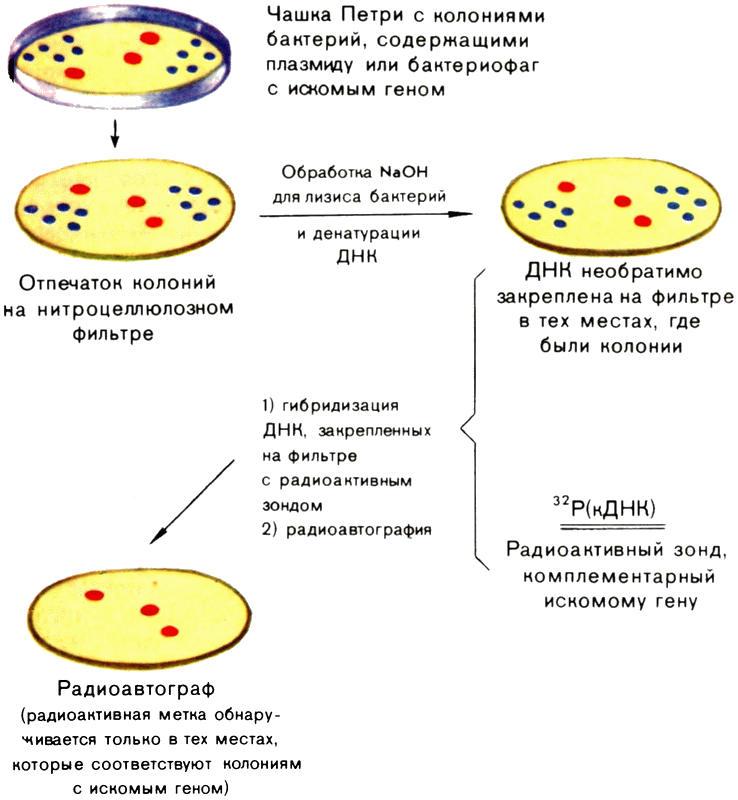 |
Рис. 29. Схема опыта по обнаружению колоний бактерий, несущих искомый ген, с помощью радиоактивного зонда. |
определяется величиной радиоактивности) фотопленку проявляют. Зона с радиоактивной ДНК выглядит на пленке как маленькое темное пятнышко. Эта процедура называется радиоавтографией. Зная, где это пятнышко находится на фильтре, можно найти на газоне бляшку, в которой находится фаг с искомой рекомбинантной ДНК (рис. 29). Остается только размножить его в культуре клеток кишечной палочки, выделить из него ДНК и из этой ДНК вырезать вставку той же рестриктазой EcoRI. Эта вставка — индивидуальный фрагмент {73} одной из хромосом мыши, содержащий нужный ген! Еще недавно этот фрагмент был спрятан среди миллиона, казалось бы, ничем не отличающихся друг от друга фаговых частиц, и вот теперь он в руках исследователей.
Сегмент ДНК с интересующим нас геном обычно по длине в несколько раз больше самого гена (помните, фаговый вектор сконструирован так, чтобы величина клонируемой ДНК была 15—20 тыс. пар нуклеотидов, а средняя длина гена — 1—2 тыс. пар нуклеотидов). Вот почему работа по получению индивидуального гена на этом не заканчивается. Помогут изолировать ген все те же рестриктазы и тот же зонд, который был использован для скрининга «библиотеки» генов.
Сегмент ДНК, извлеченный из «библиотеки» генов, расщепляют различными рестриктазами, получающиеся фрагменты разделяют электрофорезом в агарозном геле. Дальнейшая задача состоит в том, чтобы определить, в какой из электрофоретических зон находится нужный ген. Перенесем ДНК из этих зон на нитроцеллюлозный фильтр. Для этого сразу после окончания электрофореза на пластинку агарозного геля, еще пропитанного раствором электролита, накладывают нитро-целлюлозный фильтр, а сверху на него кладут несколько листов толстой фильтровальной бумаги, и все это помещают под пресс. Фильтровальная бумага будет всасывать в себя раствор из геля, но по дороге он проходит через фильтр, и ДНК, увлекаемая растворителем и вымывающаяся из электрофоретических зон, задержится на фильтре. Ее положение на фильтре точно соответствует положению на электрофоретической пластинке. Таким образом получен отпечаток картины электрофореза на нитроцеллюлозном фильтре. Эту операцию называют блоттингом (от английского слова — промокательная бумага).
Все остальные операции осуществляются так же, как и при скрининге «библиотеки» генов: ДНК на фильтре денатурируют, затем на нем необратимо закрепляют прогревом и гибридизуют ее с зондом. Те зоны ДНК, которые содержат искомый ген (или его фрагменты), свяжутся с радиоактивной меткой. Их обнаруживают радиоавтографией. Легко сообразить, что радиоактивно меченными могут оказаться сразу несколько зон ДНК, а не одна, хотя мы имеем дело с индивидуальным геном: {74} рестриктазы могут разрезать этот ген на части и он попадет в разные фрагменты ДНК, отличающиеся по размеру. Совмещая радиоавтограф с электрофореграммой, теперь точно можно установить, в какой части «библиотечного» сегмента ДНК находится интересующий нас ген.
Остается только этот ген размножить. (Многие из вас могут сообразить, как это сделать.) Однако доведем объяснение до конца. Воспользуемся плазмидным вектором, который носит название pBR322. Наверное, это самый популярный вектор у генных инженеров. Он содержит сразу два гена устойчивости к антибиотикам — тетрациклину и ампициллину (родственнику обычного пенициллина). В составе этих генов есть по нескольку участков узнавания различными рестриктазами, причем каждый из таких участков уникален, т. е. встречается в векторе только один раз.
Теперь из рестрикционных фрагментов ген выберем такой, в котором нужный ген содержится целиком, но размеры которого не слишком превышают длину самого гена. Такой выбор помогает сделать вдумчивый анализ картины гидролиза «библиотечного» сегмента ДНК различными рестриктазами, полученной на предыдущем этапе. Допустим, что подходящий фрагмент есть и он получается при расщеплении сегмента из «библиотеки» генов рестриктазой BAmHI. В плазмиде pBR322 участок разрезания (последовательность GGATCC) этой рестриктазой находится в гене устойчивости к тетрациклину. Разрежем плазмиду BamHI, встроим в нее выбранный фрагмент и трансформируем такой рекомбинантной ДНК кишечную палочку. Последующий путь отбора клеток с рекомбинантной ДНК ясен: исходные клетки (без вектора) чувствительны как к тетрациклину, так и к ампициллину, клетки с неизменным вектором растут в присутствии обоих антибиотиков, а клетки с рекомбинантным вектором (т. е. с нашим геном) только в присутствии ампициллина. Замечательное свойство плазмиды pBR322 заключается в том, что она, как говорят, мультикопийна, т. е. в каждой клетке можно получить несколько десятков (а в специальных условиях и несколько сот) молекул рекомбинантной ДНК. Обычно отклонированный этим способом ген так и хранят в составе плазмиды, которая в любой момент может быть размножена в клетке. Плазмида стабильна, {75} и ее даже можно послать письмом по почте своему коллеге, запечатав в маленький пластиковый пакетик.
Как заставить ген работать на новом месте. На примере поиска нужного гена в «библиотеке» генов мы познакомились со многими основными приемами генной инженерии. Однако картина была бы далеко не полной, если бы мы не рассказали о том, как при клонировании генов используется способность этих генов экспрессироваться (выражаться, т. е. синтезировать иРНК и белок) в чужеродной клетке.
Сама проблема синтеза белков с помощью чужеродных генов, например генов человека в кишечной палочке, далеко не простая. И важна она не столько для отбора клеточных клонов с нужным геном, сколько, как вы увидите дальше, для получения необходимых человеку белков в быстрорастущих клетках микроорганизмов.
Вспомним, что под экспрессией гена понимается синтез на этом гене предшественника иРНК (т. е. полноценная его транскрипция), процессинг иРНК (т. е. превращение ее в зрелую иРНК) и трансляция этой иРНК (синтез белка с помощью РНК-матрицы на рибосомах). К этому нужно добавить, что образующийся белок должен быть устойчив в чужеродной клетке. Кроме того, часто требуется, чтобы белок после образования в цитоплазме клетки был транспортирован (или, как говорят, секретирован) через клеточные мембраны наружу клетки. Для этого на его N-конце должна содержаться специальная последовательность, обладающая сродством к клеточным мембранам. А ведь клетки прокариот и эукариот (в нашем случае кишечной палочки и человека) используют совершенно разные сигналы транскрипции, трансляции, процессинга и транспорта белков.
Многие белки эукариот после завершения синтеза полигликозилируются: к белку пришивается короткая цепочка полисахарида, что сказывается на их активности и на их транспорте внутри клетки. Более того, не забывайте, что многие гены эукариот в отличие от прокариотических генов состоят из экзонов и интронов, а системы ферментов сплайсинга, которые бы удалили интроны и правильным образом сшили друг с другом экзоны, в кишечной палочке нет.
Отметим, что последняя трудность разрешается сравнительно легко: достаточно получить полноразмерную {76} ДНК-копию (кДНК) зрелой информационной РНК, из которой уже удалены интроны. Что же касается различных сигнальных последовательностей, то здесь можно пойти двумя путями.
Во-первых, можно снабдить эукариотический ген всеми необходимыми сигналами прокариотической клетки. Эти сигналы (промоторы, терминаторы, сигналы транспорта) в виде фрагментов ДНК генные инженеры всегда держат под рукой. Единственное, что сделать пока не удается, это гликозилировать белки в бактериальной клетке. К счастью, многие белки (например, интерферон) обладают активностью и без полисахаридной привески. Если же такая модификация все же необходима, то вместо бактериальной клетки придется поместить ген в клетки животных, о чем речь пойдет дальше.
Во-вторых, чтобы обеспечить экспрессию чужого гена в клетках кишечной палочки, можно сшить его с каким-нибудь геном этой клетки. Создавая генетические конструкции этим способом, генные инженеры предпочитают использовать ген β-галактозидазы, о котором не раз уже говорилось. Вот, например, как был получен продуцент белка, из которого можно наработать один из гормонов человека — соматостатин! (Подробнее об этом гормоне расскажем в следующей главе.)
Соматостатин — это даже не белок, а полипептид: он состоит всего из 14 аминокислотных остатков. Это значит, что его ген имеет длину 42 нуклеотидных остатка. На самом деле был получен более длинный двутяжевой полинуклеотид, состоящий из 52 нуклеотидных остатков, так как к гену нужно было присоединить «липкие» рестриктазные концы. Кроме того, как видно на рисунке, в начало этого гена был вставлен также кодон AUG (на языке ДНК—ТАС). Этот кодон соответствует аминокислоте метионину. Синтетический ген соматостатина был встроен в плазмидный вектор так, чтобы он оказался «в хвосте» гена β-галактозидазы (который заранее был помещен в тот же вектор вместе со всеми необходимыми сигналами). Такой рекомбинантный ген β-галактозидазы после трансформации вектором кишечной палочки прекрасно в ней экспрессировался: ведь он был в своей родной стихии, а белок, который при этом получался, представлял собой гибрид, или химеру, β-галактозидазы и соматостатина. Его выделили, и теперь предстояло отделить гормон от фермента (рис. 30).
| {77} |
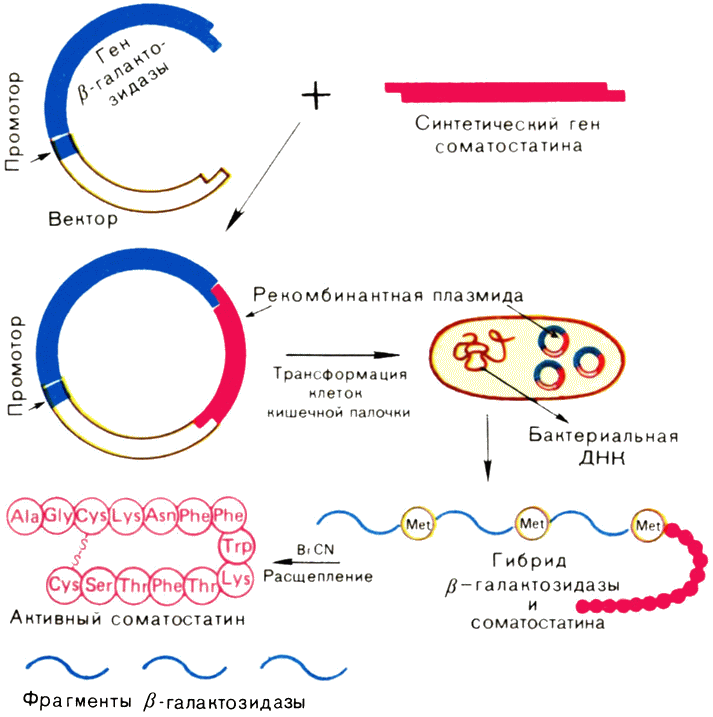 |
Рис. 30. Получение человеческого гормона соматостатина в клетках кишечной палочки. |
Вот здесь и был использован остаток метионина, дополнительно вставленный в химеру при конструировании ее гена. Простое химическое соединение — бромциан (BrCN) — расщепляет белки по метионину. А так как в самом соматостатине метионина нет, то гормон после обработки химеры бромцианом получается в неповрежденном виде.
Есть и другие варианты получения химер. Можно, например, из хозяйского белка оставить только несколько первых (N-концевых) аминокислотных остатков, зато использовать все его сигнальные последовательности. Такой небольшой привесок, как правило, на активности белка не сказывается. {78}
Итак, теперь мы знаем, как добиться того, чтобы клетка, получив чужеродный ген, производила закодированный в нем белок. Вернемся же к технике клонирования генов и посмотрим, как это обстоятельство может быть использовано для селекции клеток, несущих интересующий нас ген.
Самый простой случай — это когда ген кодирует белок, который сама клетка не производит, но без этого белка расти не может. Например, если белок — продукт нашего гена — участвует в биосинтезе аминокислоты гистидина, нужно взять клетки — ауксотрофы — по гистидину. Трансформируем эти клетки вектором с нашим геном и будем выращивать их на среде без гистидина. Вырастут на такой среде только те клетки, которые содержат вектор с искомым геном. Они и станут источником для его получения.
Удобно отбирать клоны с неким индивидуальным геном, когда продукт этого гена имеет ярко выраженную биологическую активность. Например, фермент, активность которого может быть определена с помощью какого-либо чувствительного метода. Выше мы говорили об отборе голубых колоний кишечной палочки, синтезирующей β-галактозидазу, с помощью «Х-гал». А вот другой пример. Вам, наверное, приходилось наблюдать летней южной ночью светлячков. Светятся они благодаря специальному органу, в котором вырабатывается фермент люциферин-люцифераза. Этот фермент в присутствии универсального аккумулятора энергии — аденозинтрифосфата (АТФ) — образует вещество с сильной люминисценцией (кстати, благодаря такой активности люциферин-люциферазу широко используют для определения концентрации АТФ в биологических объектах). Ген люциферин-люциферазы удалось недавно отклонировать в клетках кишечной палочки, причем колонии бактерий с этим ферментом светились как светлячки и их отбирали по этому признаку.
Еще один очень эффективный способ отбора колоний основан на иммунологических тестах. Обычно его применяют тогда, когда клонируют ген уже достаточно хорошо известного белка, на который можно выработать антитела. Впервые этот метод был применен для отбора клонов кишечной палочки, содержащих ген инсулина (точнее гены: ведь инсулин, хотя и маленький белок, состоит из двух полипептидных цепей, соединенных
| {79} |
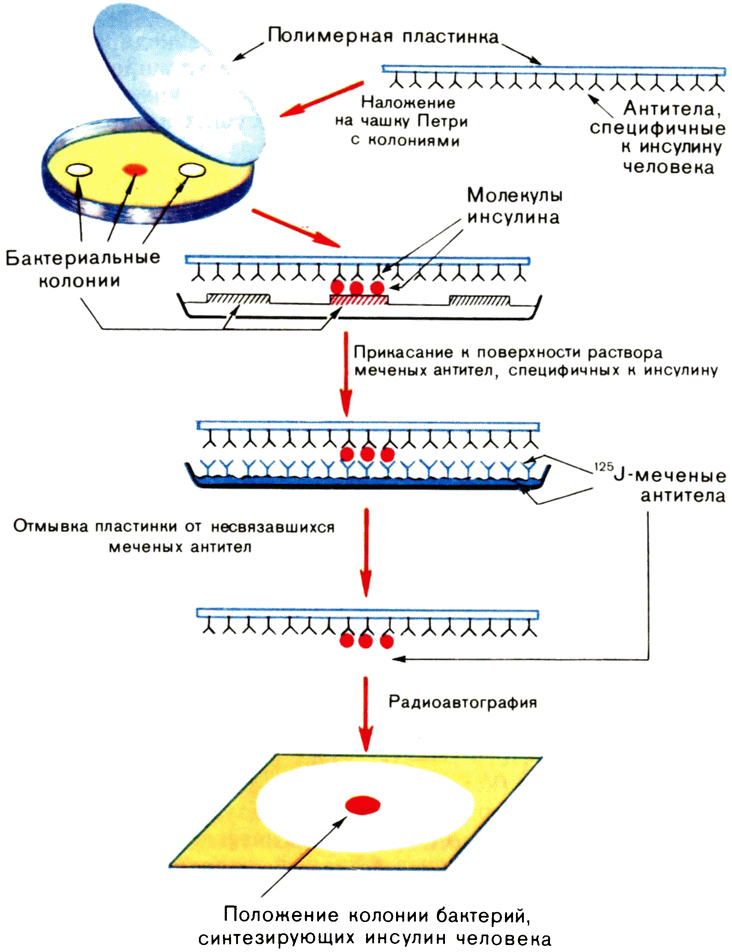 |
Рис. 31. Схема поиска бактериальных клеток, синтезирующих инсулин человека, с помощью антител. |
S—S-связями). Почему гены инсулина пришлось переносить в бактериальную клетку, вы узнаете в другой главе. А сейчас на этом примере давайте рассмотрим суть иммунологического метода отбора клонов. {80}
Векторы с генами инсулина были сконструированы уже знакомыми нам методами. После того как бактерии, трансформированные этими векторами, вырастили на чашках Петри, с них получили реплики. Однако на этот раз нитроцеллюлозные фильтры заменили на пластинки из поливинилхлорида, к которым были пришиты антитела к инсулину. Клетки, содержавшие векторы с геном инсулина, не только синтезировали этот гормон, но и секретировали его. Поэтому в тех местах, где находились такие колонии, был и свободный инсулин. Он прилипал к антителам, закрепленным на полимере. Обнаруживали положение этих прилипших молекул инсулина вновь с помощью антител, но уже меченных радиоактивным йодом 125J так, как это изображено на рисунке 31. Так же, как и 32Р, радиоактивную йодную метку можно обнаружить на рентгеновской пленке посредством радиоавтографии. По положению радиоактивных зон на полимерной пластинке можно установить местоположение колоний бактерий с активным геном инсулина. Эти клетки стали затем прародителями промышленных продуцентов инсулина.
Клонирование генов в клетках эукариот. До сих пор мы рассматривали клонирование генов в бактериальных клетках, в том числе и тех генов, которые были извлечены из хромосом эукариот. А нельзя ли научиться переносить рекомбинантные ДНК прямо в эукариотические клетки и там заставить их экспрессироваться?
Вопрос этот имеет огромное практическое значение: ведь если мы действительно рассчитываем направленно создавать новые виды растений и животных, если хотим активно бороться с генетическими заболеваниями человека, то должны уметь включать в геном высших организмов гены, сконструированные вне клетки. В последующих главах вы познакомитесь с первыми успехами генной инженерии растений и животных. А сейчас коротко рассмотрим векторные системы, которые удалось создать для переноса рекомбинантной ДНК в эукариотические клетки.
Техника встраивания генов в эукариотические векторы и их клонирования в принципе та же, что и в случае бактериальных клеток. Однако сами эукариотические векторы отличаются от бактериальных. Конечно, они также имеют удобные участки для разрезания рестриктазами и маркерные гены. Но создают их на базе геномов {81} плазмид и вирусов эукариот: им предстоит реплицироваться в эукариотической клетке и они должны быть приспособлены к ферментам и факторам, управляющим репликацией ДНК в таких клетках. Кроме того, в случае эукариот часто нужно стремиться к тому, чтобы чужеродный ген встроился (интегрировал) в хромосому клетки — реципиента. Тогда эукариотические векторы приходится снабжать элементами, обеспечивающими такое встраивание.
Начнем с простейшего эукариота — дрожжей. Дрожжи — это низшие одноклеточные грибы. По всем признакам это настоящие эукариоты: у них есть ядро, отделенное от цитоплазмы ядерной оболочкой, а весь ферментативный аппарат репликации ДНК, транскрипции и трансляции у них практически такой же, как и у остальных эукариот. У дрожжей работают ферменты — гликозилирующие белки. В то же время дрожжи быстро растут, используя даже такие субстраты, как парафин и метиловый спирт. Они уже давно стали промышленными микроорганизмами, их умеют прекрасно выращивать в заводских условиях. Они безопасны для человека и растут на дешевой среде. Следовательно, дрожжи очень перспективный объект для промышленного производства ценных продуктов любых эукариотических генов. Кроме того, геном дрожжей не так уж велик — 1,7 × 107 пар нуклеотидов на гаплоидную клетку (сравните с 3 × 109 пар нуклеотидов в геноме человека). А главное, он досконально изучен генетиками.
Правда, один недостаток у дрожжевых клеток есть: они покрыты очень плотной клеточной оболочкой, совершенно непроницаемой для молекул ДНК. Но здесь на помощь приходит обыкновенная виноградная улитка. Она вырабатывает ферменты — β-глюконазы, разрушающие полисахариды, из которых построена клеточная стенка дрожжей. β-глюконазы превращают дрожжи в «раздетые клетки» — так называемые протопласты, у которых цитоплазма окружена уже только тонкой, легкопроницаемой мембраной. Их обычно и трансформируют рекомбинантными ДНК. Важно, что через некоторое время стенка у дрожжевой клетки восстанавливается и рекомбинантная ДНК оказывается включенной в полноценную клетку.
Многие штаммы дрожжей содержат плазмиду — циклическую ДНК длиной 2 мкм (6300 пар нуклеотидов). {82} Ее так обычно и называют — «плазмида 2 мкм». Она мультикопийна: клетка дрожжей может иметь до 100 ее копий. Однако, чтобы превратить ее в вектор, пришлось изрядно потрудиться: вставить в нее маркерные гены (в самой плазмиде 2 мкм их нет), убрать лишние рестрикционные участки и сохранить при этом ее способность реплицироваться в клетках дрожжей.
Из плазмиды 2 мкм получено уже множество векторов. Пожалуй, самые интересные из них получили название челночных векторов. Эти векторы могут реплицироваться не только в клетках дрожжей, но и в клетках кишечной палочки благодаря тому, что в них встроили фрагменты плазмид бактерий, содержащие бактериальные маркеры, а главное — участки, ответственные за их репликацию. С помощью таких «челноков» можно конструкции, созданные в бактериальной клетке, переносить в дрожжи и наоборот. Более того, некоторые «челноки» устроены так, что вместе с содержащимися в них генами могут включаться в хромосомы дрожжей. Таким образом, гены, отклонированные в кишечной палочке, удается не только размножать в дрожжах, но и «навечно» встраивать в дрожжевой геном.
Понятно, что для нормальной экспрессии чужеродных генов в дрожжах они должны быть снабжены дрожжевыми (эукариотическими) сигналами транскрипции и трансляции. Эту задачу также научились решать; сейчас получены дрожжи, продуцирующие интерфероны человека, необходимый для сыроварения химозин, инсулин и многие другие полезные белки.
Рассмотрим теперь более сложный пример — перенос рекомбинантных ДНК в клетки высших эукариот. Пока исследования здесь ведут, как правило, не на целых организмах, а на культурах клеток животных. Сейчас такие клетки, например клетки тканей человека, успешно размножают в жидкой и твердой среде, почти так же как бактерии и грибки. Правда, в культуре они гораздо капризнее. Лучше всего они растут, если в среду добавлять сыворотку крови теленка, богатую белком фетуином (α-глобулином). Лишь недавно разработаны почти полностью синтетические среды, содержащие полный набор аминокислот, витамины, ростовые факторы, соли и глюкозу. Белки — сывороточный альбумин и фетуин — все же приходится добавлять.
В таких средах удается выращивать клоны клеток, {83} полученных из эмбриональных тканей и органов человека (из кожи, мышц, легких, почек, сердца, тимуса и других желез), 5—8 месяцев. За это время они проделывают до 50 делений, а затем по еще неясным причинам перерождаются и дегенерируют. Исключение составляют клетки злокачественных, раковых опухолей. Они обладают секретом «вечной молодости», и большинство их клонов существует годами. Раковые клетки отличаются от нормальных еще и тем, что на поверхности твердой среды они образуют скопления в несколько слоев. Нормальные клетки на поверхности среды образуют слой в одну клетку (монослой). Это свойство опухолевых клеток «клеточные инженеры» научились использовать при создании так называемых гибридом, о которых еще пойдет речь.
Самый популярный объект для изготовления векторов для клеток животных — вирус SV40. Это маленький вирус с кольцевой ДНК, длиной примерно в 5250 пар нуклеотидов, который был выделен из почки мартышки (отсюда название simian virus(SV) — обезьяний). Для человека он неопасен, он может вызывать раковые заболевания у обезьян. Кроме того, в определенных условиях вирус SV40 вызывает онкогенную трансформацию (т. е. превращение нормальных клеток в раковые) многих культивируемых клеток животных, например золотистого хомячка. Как источник для конструирования векторов геном вируса SV40 привлек внимание потому, что он прекрасно реплицируется в ядре клетки. Кроме того, подобно бактериофагу X он может встраиваться в хромосомы хозяйской клетки (такое встраивание и вызывает онкогенную трансформацию клетки).
Из ДНК вируса SV40 удалось сконструировать целую серию полезных векторов, в том числе и «челноковые» векторы, с помощью которых переносят в клетки животных гены, отклонированные в бактериях. Такой перенос особенно важен, если ген состоит из интронов и экзонов: ведь даже система сплайсинга дрожжей неспособна обеспечить образование нормальных белков животных.
Немало трудностей пришлось преодолеть, прежде чем научились переносить рекомбинантные ДНК в эукариотические клетки. Самый простой прием основан на способности многих клеток поглощать с ДНК комплекс микрокристаллов фосфата кальция. Этим путем обычно {84} проводят трансфекцию клеток векторами, полученными из ДНК вируса SV40. Более утонченный прием состоит в том, что ДНК заключают в так называемую липосому, т. е. в микрокапельку водного раствора ДНК, окруженную фосфолипидной оболочкой. Стенки клеток эукариот также содержат фосфолипидные слои. Поэтому липосомы сливаются с клетками, а их содержимое переходит вовнутрь клетки.
Благодаря тому что эукариотические клетки достаточно велики, иногда удается тончайшим микрокапилляром, соединенным со шприцем, раствор ДНК впрыснуть прямо в их ядро или цитоплазму. Особенно хорошо техника микроинъекций разработана на яйцеклетках лягушек.
И наконец, переносить рекомбинантные ДНК, созданные из вирусных ДНК, можно с помощью самих вирусов. Вирусы давно приспособились проникать из клетки в клетку, поражая большие участки тканей, целые органы или организмы. И как бы сложно ни был устроен вирус, после его проникновения в клетку вирусная ДНК освобождается от вирусной оболочки и реплицируется в клетке. Вот тогда и можно подумать о том, как использовать вирусы для переноса полезных генов в многоклеточные организмы, вплоть до растений, животных и человека.
Сейчас обнаружены ДНК-содержащие вирусы (геном подавляющего большинства вирусов растений представлен РНК), паразитирующие на растительных клетках. Правда, они еще плохо изучены, и поэтому в генной инженерии растений используют векторы другого типа, о которых мы специально расскажем, когда будем рассматривать проблему переноса азотфиксирующих генов (глава 8).
Конечно, далеко не все вирусы животных и человека пригодны для переноса генов в эти организмы. Следует помнить, что речь идет о возбудителях болезней, наших злейших врагах, многие из которых стимулируют раковые заболевания. Здесь вспомнили о вирусе оспо-вакцины — живой вакцине, которая, казалось бы, уже отслужила свое, избавив человечество от одной из самых страшных болезней.
Вирус осповакцины имеет очень сложное строение. Его геном огромен по обычным вирусным масштабам: его длина 187 тыс. пар нуклеотидов. Создать векторы из {85} такой огромной ДНК невозможно, да и нет особого смысла, так как сама ДНК этого вируса не инфекционна. Оказалось, однако, что в клетке ДНК вируса осповакцины охотно рекомбинируется с любой другой ДНК, но обязательно несущей фрагменты вирусной ДНК. Эта чужеродная ДНК вместе с остальным вирусным геномом включается затем в вирусные частицы. При этом замещаться может очень большой сегмент вирусной ДНК — до 25000 пар нуклеотидов. Вот здесь и возникла замечательная возможность на основе вируса осповакцины (совершенно безопасного для человека и животных, технология производства которого отлаживалась десятилетиями) создать живую поливакцину, способную избавить человечество от многих инфекционных заболеваний. О первых успехах в этом направлении вы узнаете из следующих глав.
В завершение главы расскажем, почему один из творцов генной инженерии П. Лобан оставил микробиологию.
Историки науки сходятся во мнении, что П. Лобан был первым, кто теоретически создал полную схему получения рекомбинантных ДНК и клонирования генов. Произошло это так.
Во многих американских университетах аспиранты обязательно сдают своеобразный экзамен. Они должны разработать проект научного исследования, которое прямо не связано с темой их диссертационной работы. Но все в этом проекте: и его цель, и способы реализации — должно быть хорошо обосновано. Смысл такого экзамена — выявление творческих способностей будущего ученого.
В качестве проекта П. Лобан предложил ту схему, которую мы подробно рассмотрели в этой главе (см. рис. 24). Его экзаменаторами были выдающиеся ученые, а председателем экзаменационной комиссии — сам А. Корнберг, расшифровавший механизм биосинтеза ДНК и открывший ДНК-полимеразу. А. Корнберг был изумлен, выслушав идею П. Лобана, и настоял на том, чтобы П. Лобан бросил прежнюю работу и принялся за реализацию своей идеи. Питер Лобан последовал совету знаменитого ученого.
Через несколько месяцев работы П. Лобан обнаружил, что в соседней лаборатории П. Берг и его сотрудники работают над совершенно таким же проектом. Никакого плагиата здесь не было: П. Берг на экзамене П. Лобана не был и идея искусственного создания «липких» концов пришла ему независимо. Группа (или, как любят говорить американцы, команда) П. Берга завершила работу раньше. Статья П. Берга также вышла на год раньше статьи П. Лобана. В ней П. Берг отдал должное своему младшему коллеге. Но кто первым финишировал, тот и победитель.
П. Лобан тяжело переживал случившееся. Он решил оставить молекулярную биологию и заняться микропроцессорами.
| {86} |
За недолгие 15 лет генная инженерия превратилась в один из самых мощных инструментов познания живой материи. Получив возможность работать с индивидуальными генами, молекулярные биологи и генетики открыли совершенно новые их свойства. Именно благодаря генной инженерии обнаружено экзон-интронное строение генов эукариот, открыты многие регуляторные элементы, управляющие работой генов, выявлены мигрирующие гены. Возникла новая область молекулярной биологии — белковая инженерия: появилась возможность конструировать новые белки. Произошло это потому, что ученые могут иметь в своем распоряжении любой ген в индивидуальном состоянии и проводить изучение его структуры всеми доступными им методами. До недавнего времени специалисты работали лишь с механической смесью многих тысяч генов, к тому же разорванных случайным образом.
Как прочитать генетический текст. Первый вопрос, на который теперь можно получить ответ, — это первичная структура (или последовательность чередования нуклеотидных остатков) гена. Пятнадцать лет назад задача определения нуклеотидной последовательности сегмента ДНК длиной лишь в несколько десятков нуклеотидов (напомним, что средняя длина генов приближается к тысяче нуклеотидных остатков) не всегда была разрешимой. (Правда, с определением первичной структуры РНК дело обстояло лучше.)
Для РНК уже давно обнаружены ферменты — рибонуклеазы, которые расщепляли ее цепь специфически, т. е. после определенных остатков нуклеотидов {87} (или, проще, по определенным буквам записанного в ней генетического текста). Так, рибонуклеаза TI, выделяемая из низшего гриба — аспергиллуса, разрезает любую РНК после остатков гуаниловой кислоты (т. е. после буквы G), а рибонуклеаза А из поджелудочной железы млекопитающих расщепляет РНК после пиримидиновых нуклеотидов (т. е. после букв U и С). Поэтому молекулу РНК можно постепенно расщеплять на все более и более мелкие перекрывающиеся фрагменты (вспомните частичное расщепление ДНК при построении их рестрикционных карт) до тех пор, пока не получались короткие олигонуклеотиды, доступные для химического анализа.
Первыми были исследованы транспортные РНК — самые короткие из известных тогда РНК (они состоят из 70—80 нуклеотидных остатков). В середине 60-х годов в лабораториях Холли (США) и А. А. Баева (СССР) их сначала научились получать в индивидуальном состоянии, а затем определили их нуклеотидную последовательность. Потребовалось еще 10 лет, чтобы определить нуклеотидную последовательность вирусной РНК длиной примерно в 3500 нуклеотидных остатков. Эта работа требовала огромного труда самых искуснейших экспериментаторов.
Для ДНК ферментов, подобных специфическим рибонуклеазам, известно не было. Но с открытием рестриктаз изучение нуклеотидной последовательности сдвинулось с места. Теперь появилась возможность некоторые из доступных индивидуальных ДНК (к ним относились ДНК мелких вирусов и бактериофагов) направленно разрезать на фрагменты, с этих фрагментов с помощью РНК-полимеразы получать комплементарные РНК-копии и наконец, определять нуклеотидную последовательность этих РНК.
Однако метод определения первичной структуры, как его часто называют секвенирования (от английского слова — последовательность) оставался прежним, очень медленным и сложным. Число же клонированных генов и их фрагментов росло. Требовались принципиально новые методы, которые бы в сотни раз ускорили анализ последовательности ДНК. И такие методы были разработаны.
Рассмотрим два из них, наиболее совершенных и распространенных. Первый называют методом Максама {88} — Гилберта, по имени его создателей известного американского ученого У. Гилберта и его сотрудника А. Максама. А. Максаму и У. Гилберту ничего не пришлось изобретать заново. Они «лишь» довели до совершенства идеи и разработки, по частям заложенные в работах многих предшественников: советских ученых С. К. Василенко, Е. Д. Свердлова, А. Д. Мирзабекова, бельгийца В. Фирса, англичанина Ф. Сэнгера и некоторых других. В чем суть этого метода?
Рестрикционный фрагмент двутяжевой ДНК длиной в несколько сот пар нуклеотидов метят радиоактивным фосфором по его 5'-концам. Делают это с помощью фермента полинуклеотидкиназы, который выделяют из клеток кишечной палочки, зараженной бактериофагом Т4. Этот фермент отщепляет фосфатную группу от молекулы АТФ и переносит ее на 5'-конец полинуклеотида. Затем двуспиральную ДНК денатурируют и отдельные цепи ДНК разделяют электрофорезом в геле. После разделения каждую из цепей отдельно вымывают из геля и в отдельности изучают.
Далее наступает самый важный момент анализа: надо расщепить ДНК избирательно, по каждому из четырех видов нуклеотидов, ее составляющих; причем сделать это следует так, чтобы в каждом случае каждая отдельная цепь ДНК расщепилась только один раз. На рисунке 32 показано, как эти требования выполняются на примере сравнительно короткой нуклеотидной последовательности ДНК. Заметим, что А. Максаму и Г. Гилберту не удалось найти условий избирательного расщепления ДНК по А и по Т. Но это не является препятствием, так как существуют условия, когда ДНК расщепляется только по G и только по С.
В каждом случае то звено, по которому проводится расщепление цепи, предварительно химически видоизменяется (модифицируется). Эта модификация как раз и должна проходить так, чтобы в каждом случае видоизменялась в среднем одна из букв на одну молекулу ДНК.
Из рисунка 32 видно, что препарат ДНК, разделенный на четыре порции, дает четыре набора фрагментов. Их фракционируют также электрофорезом в геле. На этот раз гель изготавливают из полиакриламида. Для этого в узкий промежуток между двумя стеклами заливают раствор акриламида вместе с некоторыми
| {89} |
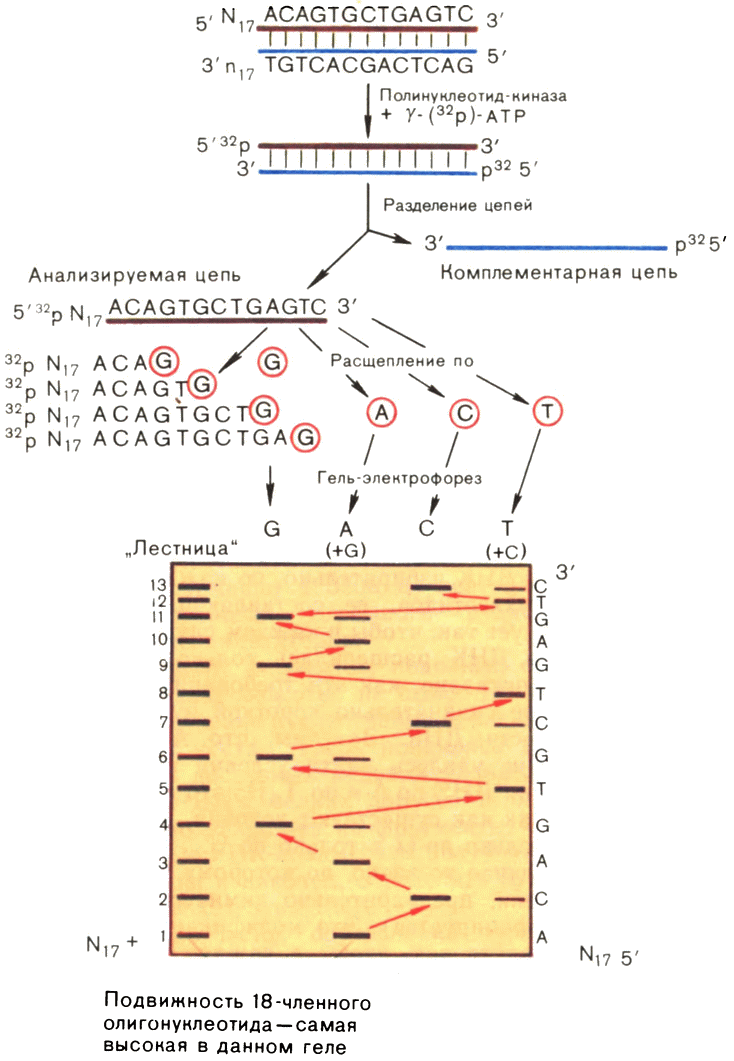 |
Рис. 32. Схема определения 13-членной нуклеотидной последовательности в 30-членном полинуклеотиде химическим методом Максама — Гилберта. Фрагменты короче 18 нуклеотидов «ушли» за пределы геля. |
| {90} |
добавками. Полимеризуясь, акриламид образует длинные полимерные цепи, а добавки сшивают эти цепи в некоторых местах. В итоге получается полимерная сетка, которая набухает в воде и дает прозрачный бесцветный гель, напоминающий желе. Полимеризацию ведут в растворе электролита, содержащего денатурирующие агенты (обычно мочевину), которые не дают фрагментам ДНК слипаться во время электрофореза. Смесь фрагментов ДНК наносят на верхнюю часть геля (в специально изготовленные там лунки); гель соединяют с сосудами, где находятся электролит и электроды. Электрофорез проводят при высоком напряжении (1500—2000 В). Как и обычно, при электрофорезе в геле низкомолекулярные фрагменты движутся быстрее, чем более крупные. Электрофорез, который здесь применяется, настолько совершенен, что он позволяет разделить все фрагменты ДНК по их длине. Иными словами, отделить, скажем, фрагмент длиной в 91 нуклеотидный остаток от фрагментов длиной в 90 и 92 остатка. Это условие обязательное: без такой максимальной разрешающей способности определить последовательность ДНК нельзя. Кроме того, чем длиннее участок электрофореграммы, на котором в данном геле происходит разделение фрагментов с точностью до одного нуклеотида, тем длиннее сегмент ДНК, последовательность которого может быть определена в одном опыте. Многое, конечно, и здесь зависит от искусства экспериментатора, но определение последовательности участка ДНК длиной в 200—250 остатков в одном эксперименте никого сейчас не удивляет.
Остается добавить, что, как и обычно, зоны фрагментов ДНК выявляют на электрофореграмме с помощью авторадиографии (на гель в темноте накладывается рентгеновская фотопленка, которая засвечивается только в тех местах, где есть радиоактивная метка). На фотопленке видны лишь те фрагменты ДНК, которые помечены по 5'-концу, а расстояние, которое они прошли от верха геля, точно соответствует их длине. Теперь остается «прочитать» последовательность ДНК снизу вверх, каждый раз отыскивая ближайшую по горизонтам букву. Образец такой авторадиографии вы видите на рисунке.
Важно, что, просеквенировав вторую, комплементарную цепь фрагмента ДНК, исследователь имеет {91} возможность проверить данные, полученные для первой цепи. Нужно лишь помнить, что G и Т в одной цепи соответствуют С и А в другой.
Второй метод секвенирования ДНК разработал замечательный английский ученый Ф. Сэнгер. На научном языке этот метод называют методом «с обрывом цепи» или «дидезокси»-методом. Прежде чем перейти к сути этого метода, скажем несколько слов о его создателе.
В 50-е годы Ф. Сэнгер прославился работами по определению полной аминокислотной последовательности белка-гормона инсулина. Это был первый случай, когда удалось расшифровать полную первичную структуру белка, причем всю методику исследований разработал сам Ф. Сэнгер. Пионерская работа Ф. Сэнгера, отмеченная Нобелевской премией по химии, породила целую серию расшифровок аминокислотных последовательностей белков.
В начале 1964 г. Ф. Сэнгер прочитал в Московском университете цикл лекций по структуре белков. Но свою последнюю лекцию он неожиданно для всех посвятил РНК, сообщив, что переключается на изучение нуклеиновых кислот. После этого он революционизировал методы секвенирования РНК, и первичная структура вирусной РНК, о которой мы упоминали, была определена его методом. Когда появилась возможность секвенировать большие ДНК, Ф. Сэнгер переключился на эту проблему. Он, в частности, нашел те условия электрофореза в полиакриламидном геле, которые позволяют разделять фрагменты ДНК, отливающиеся на один нуклеотидный остаток (их применили в своем методе А. Максам и У. Гилберт). Вклад Ф. Сэнгера в изучение структуры ДНК был так велик, что ему присудили вторую Нобелевскую премию по химии. До него только один исследователь — прославленная Мария Кюри была дважды удостоена этой высшей научной награды.
Многие детали методов Ф. Сэнгера и Максама — Гилберта сходны. Но есть и принципиальное отличие — секвенирование по Сэнгеру ведут с помощью ДНК-полимеразы, т. е. с помощью фермента, который не расщепляет, а синтезирует цепь ДНК. Этот принцип, несмотря на все последующие усовершенствования, до сих пор остался неизменным. В современном варианте, работая по методу Сэнгера, поступают следующим образом. {92}
Сегмент ДНК, нуклеотидную последовательность которого собираются определить, встраивают в специальный вектор, изготовленный из ДНК бактериофага М13. Здесь следует вернуться к знакомой вам технике получения рекомбинантных ДНК.
Бактериофаг М13 необычный: он содержит одно-цепочную кольцевую ДНК. Эта его особенность, как вы увидите дальше, и используется при секвенировании ДНК. Когда фаговая ДНК попадает в клетку кишечной палочки, она превращается в обычную двутяжевую кольцевую ДНК, которая реплицируется подобно другим фаговым или плазмидным ДНК. Значит, геном фага М13 можно иметь как в однотяжевом, так и в двутяжевом виде.
Из двутяжевой ДНК фага М13 сконструировали серию замечательных векторов. В ту ее область, которая не важна для репликации, встроили полилинкер с местами разрезания примерно десятком различных рестриктаз, а все остальные участки для тех же рестриктаз из ДНК убрали (таким образом, в полилинкере эти участки уникальны). Рядом с полилинкером встроили универсальную нуклеотидную последовательность из 17 нуклеотидных пар. В такой вектор после разрезания его одной из рестриктаз встраивают фрагмент ДНК, полученный посредством той же рестриктазы. Заметьте, что встроенный фрагмент оказался рядом с универсальной 17-членной последовательностью. Такой рекомбинантной ДНК заражают (трансфецируют) клетку. Рекомбинантная ДНК размножается в клетке и, одеваясь фаговыми белками, превращается в фаговые частицы. Однако в фаг попадает только одна из цепей, и, выделяя фаг, а затем фаговую ДНК, мы сразу получаем ее в однотяжевой форме.
Теперь можно непосредственно приступать к секвенированию ДНК методом «обрыва цепи». Как мы говорили, в основе этого метода лежит ДНК-полимеразная реакция. А для ДНК-полимеразы обязательно требуется затравка. Для этого и была вставлена рядом с секвенируемым фрагментом 17-членная последовательность. Она расположена справа от него, т. е. ближе к 3'-концу молекулы ДНК. Затравкой будет 17-членный олигонуклеотид, комплементарный этой последовательности.
Если олигонуклеотид-затравку связать с ДНК-матрицей, {93} а затем добавить ДНК-полимеразу и дезоксинуклеозидтрифосфаты, то получим полную ДНК-копию нужного фрагмента. Заметьте, что в ДНК-полимеразной реакции каждое последующее звено цепи присоединяется к гидроксильной группе на ее 3'-конце.
Идея Ф. Сэнгера заключалась в том, что вместе с нормальными дезоксинуклеозидтрифосфатами (dNTP) в реакционную смесь вводили дидезоксинуклеозидтрифосфат (ddNTP). Посмотрите внимательно на рисунок: остаток рибозы в ddNTR лишен гидроксилов как при 2'-, так и при 3'-атомах углерода. Если такой остаток попадет на 3'-конец растущей цепи, то и ДНК-полимераза не сможет присоединить к нему следующее звено, и в этой точке рост цепи остановится. Можно так подобрать соотношение dNTP и ddNTP, что остановка роста цепи будет происходить в среднем один раз на каждую растущую цепь. И тогда, проведя реакции полимеризации для каждого из четырех нуклеотидов, получим по сути дела такие же фрагменты, что и в случае метода Максама — Гилберта. Читая электрофореграмму (вернее, ее радиоавтограф), помните, что секвенируемый сегмент ДНК комплементарен синтезирующейся цепи (не забывайте переводить G в С, С в G и т. д., рис. 33).
Чтобы проиллюстрировать значение методов Максама — Гилберта и Сэнгера для современной молекулярной биологии и генетики, приведем такие цифры. В 1965 г. была известна первичная структура двух тРНК (общей длиной около 150 нуклеотидных остатков); к 1975 г., когда техника секвенирования РНК, казалось бы, достигла совершенства, удалось узнать первичную структуру более сотни различных РНК и фрагментов ДНК, общая длина которых составила около 10 000 нуклеотидных остатков; к 1986 г. была определена полная первичная структура многих вирусных геномов и плазмид, множества генов и регуляторных районов ДНК, суммарная длина которых превысила 6 млн. остатков. Сейчас известна полная первичная структура ДНК некоторых митохондрий и хлоропластов (эти клеточные структуры имеют собственную ДНК), причем в последнем случае длина молекул ДНК превышает 150 тыс. нуклеотидных пар.
Лучшее доказательство могущества современной генетической инженерии — это то, что в настоящее время
| {94} |
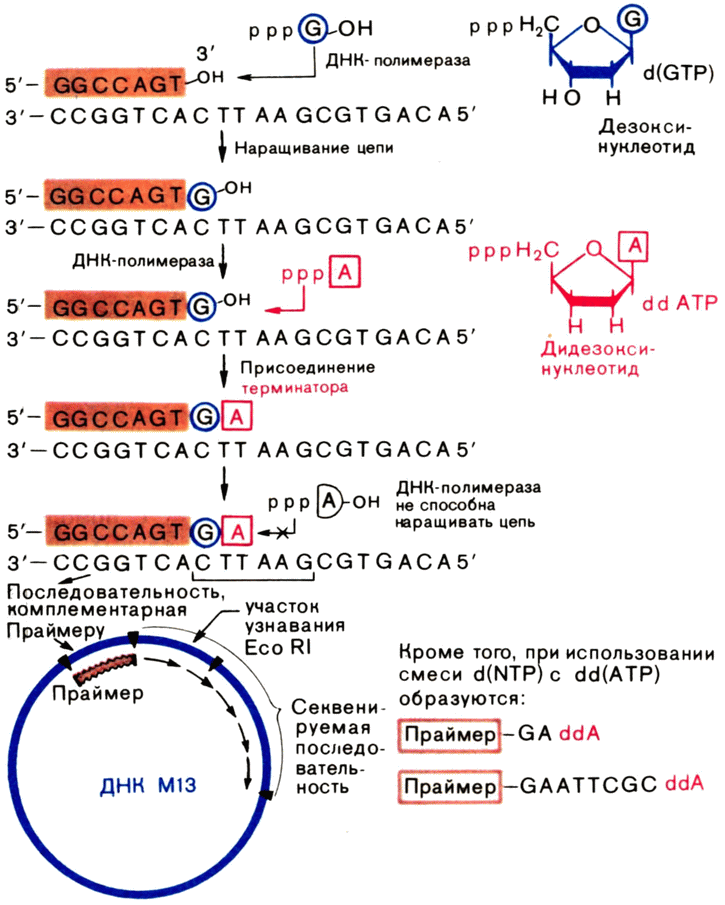 |
Рис. 33. Секвенирование ДНК терминаторным методом Сэнгера. |
идет серьезное обсуждение проекта секвенирования всего генома человека: ДНК общей длиной в 3 × 109 пар нуклеотидов! Конечно, технику секвенирования ДНК для решения такой грандиозной задачи (которую можно сравнить только с космическими проектами) потребуется усовершенствовать. Подсчитано, что самый опытный экспериментатор, занимаясь только секвенированием, {95} может определить за год последовательность ДНК длиной в 100 000 пар нуклеотидов. Это значит, что для реализации проекта секвенирования всего человеческого генома сейчас требуется 30 000 лет. Однако ученые рассчитывают в ближайшие годы не менее чем в 100 раз увеличить скорость секвенирования ДНК. Уже появились первые модели приборов, которые могут определять последовательность ДНК автоматически.
Огромная информация, получаемая генными инженерами о нуклеотидной последовательности ДНК и РНК, может храниться только в памяти мощных ЭВМ. И только на ЭВМ эту информацию можно обработать. Компьютер может найти в гене промоторный участок, выявить ту его часть, в которой закодирован белок, пользуясь генетическим кодом, написать аминокислотную последовательность белка. Вот почему определение структуры генов привело одновременно к расшифровке первичной структуры множества белков, в том числе и тех, которые содержатся в клетке в ничтожных количествах и прямо изучены быть не могут. С помощью ЭВМ можно также сравнивать структуру разных генов, определять степень их схожести и на этой основе решать вопросы эволюции биологических видов. Одним словом, компьютер для современного генетика становится таким же необходимым прибором, как и аппарат для электрофореза.
Белковая инженерия. Техника рекомбинантных ДНК и расшифровка нуклеотидных последовательностей генов позволили начать работу по конструированию новых белков, которых нет в природе. Такое конструирование преследует минимум две цели. Во-первых, оно позволяет понять, как работают те или иные белки. Во-вторых, с его помощью можно получать более совершенные белки (более активные, более стабильные и т. д.).
С одним примером получения нового белка — химеры фермента β-галактозидазы и гормона соматостатина — мы уже встречались. Химеры, как вы помните, получают, сшивая гены разных белков друг с другом. Можно представить трудность создания белка со многими взаимодополняющими активностями, что-то вроде молекулярного комбайна.
Здесь, однако, сами сшиваемые гены остаются без изменений. Тем не менее мы располагаем теперь способами {96} изменять любой нуклеотидный остаток в гене (т. е. проводить его направленный мутагенез). Такие замены в кодирующих участках генов, естественно, приводят к заменам одних аминокислот в белке на другие. Если такие замены делать по заранее разработанному плану, то в итоге можно получать белки с совершенно новыми свойствами.
Чтобы осуществить такие направленные замены, ген белка помещают в вектор, изготовленный из ДНК фага М13, точно так же, как и перед секвенированием его по методу Сэнгера. Затем к выбранному участку гена (в котором закодирован интересующий нас участок белка) синтезируют олигонуклеотид длиной в 18—20 остатков (олигонуклеотид такой длины прочно свяжется потом с геном). Этот олигонуклеотид комплементарен гену по всей длине, кроме той буквы, которую можно заменить. На рисунке он специально обозначен звездочкой. Этот олигонуклеотид используют как затравку для ДНК-полимеразы. При этом ДНК-матрицу с видоизменяемым геном используют в однотяжевой форме. ДНК-полимераза синтезирует на матрице новую цепь. В итоге получается двуспиральная ДНК с одним дефектом — после репликации получается ДНК как с исходным геном, так и с мутированным геном. Эти последние ДНК «вылавливают» из смеси, пользуясь тем же олигонуклеотидом как зондом (ход клонирования генов с помощью зондов мы подробно описали в предыдущей главе). Этот зонд будет лучше связываться с мутированным геном, чем с исходным, и можно найти такие условия, когда он будет вылавливать только рекомбинантные ДНК с мутированным геном. В результате экспрессии мутированного гена получают видоизмененный белок с запланированными заменами аминокислот (рис. 34).
Весь этот подход назвали олигонуклеотид-направляемый мутагенез генов. Создали его совсем недавно, но уже есть первые очень обнадеживающие результаты. Так, удалось сконструировать и получить фермент аминоацил-тРНК-синтетазу (тот самый, который специфически связывает аминокислоту с тРНК; см. главу 2), более активный, чем клеточный фермент. Удалось по заранее разработанному плану превратить белок-репрессор, регулирующий активность одного гена, в регулятор экспрессии другого гена. Все это только первые успехи. А возможности конструирования белковой инженерии
| {97} |
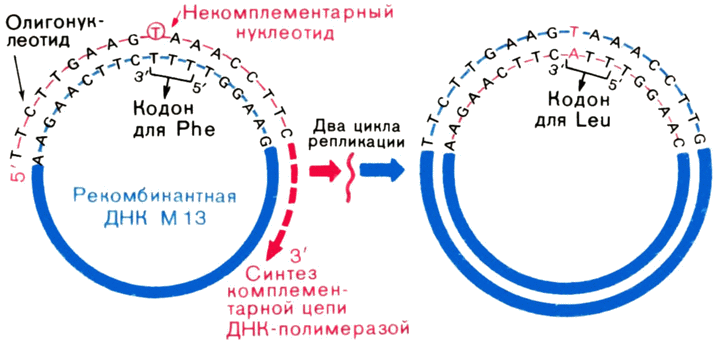 |
Рис. 34. Схема олигонуклеотид-направляемого мутагенеза гена, встроенного в однотяжевую ДНК фага М13. |
неограничены (отметьте, белковая инженерия здесь продолжение генной). Вы можете спросить: зачем это надо? Неужели в огромном запасе генов биосферы не найдется нужного гена, чтобы создавать искусственный? Оказывается, возможности биологической эволюции ограничены. Каждая мутация происходит с довольно низкой вероятностью (в среднем 10–5). Допустим, чтобы изменить белок в нужную сторону, в гене должны произойти одновременно три мутации, каждая из которых организму невыгодна (ухудшает белок), а все вместе дают желаемый эффект. Идти путем накопления мутаций нельзя: гены с одной или двумя заменами дают неэффективный белок, который может привести к смерти организма. А вероятность наступления сразу трех равна 10–5 · 10–5 · 10–5 = 10–15. Такие ничтожные вероятности в природе практически не реализуются, времени существования Земли на них просто не хватит. А искусственный, управляемый человеком мутагенез обходит эту трудность.
Затруднение в другом. Как правило, мы не знаем, как изменятся свойства белка, если в нем изменить один аминокислотный остаток на другой. Можно предсказать, например, что замена в гемоглобине в определенном положении глутаминовой кислоты на валин будет ухудшать растворимость белка, и мутантный гемоглобин, легко выпадающий в осадок, будет работать хуже. А то, что такой гемоглобин (серповидноклеточный {98} гемоглобин S) окажется ядовитым для малярийного плазмодия и что человек-мутант по этому гену не будет болеть малярией, ни один химик-белковик предсказать не сможет. Или лучше сказать, пока не сможет.
Химический синтез генов. Для решения многих задач генной и белковой инженерии требуются синтетические олигонуклеотиды, будь то полилинкеры для сшивания генов, зонды для «вылавливания» генов при их клонировании или затравки с дефектами при направленном мутагенезе. Здесь мы хотели бы рассказать о том, как проводится синтез таких олигонуклеотидов, что может сделать сейчас химик-синтетик в области создания генетического материала.
С точки зрения органической химии не только олиго-нуклеотид, но и мононуклеотид — сложные соединения. В него входят компоненты, относящиеся к различным классам органических (гетероцикл, остаток сахара) и неорганических (остаток фосфорной кислоты) соединений. Нуклеотиды содержат множество различных по свойствам функциональных групп. Именно эти группы, столь необходимые для создания правильной макромолекулярной структуры нуклеиновых кислот, обеспечивающие комплементарность полинуклеотидных цепей, представляют наибольшую трудность при химическом синтезе олигонуклеотидов.
Задача такого синтеза, на первый взгляд, выглядит просто: нужно шаг за шагом (в том порядке, который задан нуклеотидной последовательностью олигонуклеотида) связывать фосфатную группу одного нуклеотида с гидроксильной группой другого так, чтобы каждый раз образовывалась 3'—5'-фосфодиэфирная связь. Сам по себе остаток фосфорной кислоты с гидроксилом сахара реагировать не будет; как сказали бы химики, он недостаточно реакционноспособен, его нужно дополнительно активировать. Это значит, что к фосфорной группе нужно направленно (не затронув другие функциональные группы нуклеотида) присоединить активирующую группировку. Далее реакцию активированного фосфата нужно прицельно провести с «правильной» ОН-группой сахара. Но по свойствам эта группа так похожа на функциональные группировки в других частях мононуклеотида, что единственный выход — как-то выключить эти группы из «игры». Приходится их защищать, т. е. навешивать на них защитные группировки, {99} делая недоступными для реакций с активированной фосфатной группой.
Сильно упрощенная схема такого синтеза приведена на рисунке. Понятно, как много операций должен совершить химик-органик, чтобы получить олигонуклеотид всего из двух звеньев. Причем эти операции должны монотонно повторяться для присоединения каждого нового звена. К тому же в конце синтеза олигонуклеотид нужно освободить от всех защитных группировок. Возникла мысль: нельзя ли все эти операции автоматизировать?
Упорная многолетняя работа завершилась успехом. Автоматические синтезаторы олигонуклеотидов появились во многих лабораториях. Прибор, созданный в нашей стране в год сорокалетия Победы над фашизмом, получил название «Виктория-4». В этом названии звучат отзвуки победы, одержанной учеными над сложной научно-технической проблемой, а также имя одного из пионеров автоматического синтеза олигонуклеотидов В. К. Потапова. В. К. Потапов и З. А. Шабарова одними из первых сумели разработать так называемый твердофазный синтез олигонуклеотидов. Он и положен в основу работы автоматического синтезатора.
Главный элемент автоматического синтезатора олигонуклеотидов — небольшой реактор — трубочка, заполненная полимером, приготовленным в виде мелких шариков (зерен). С зернами полимера химически сшит первый
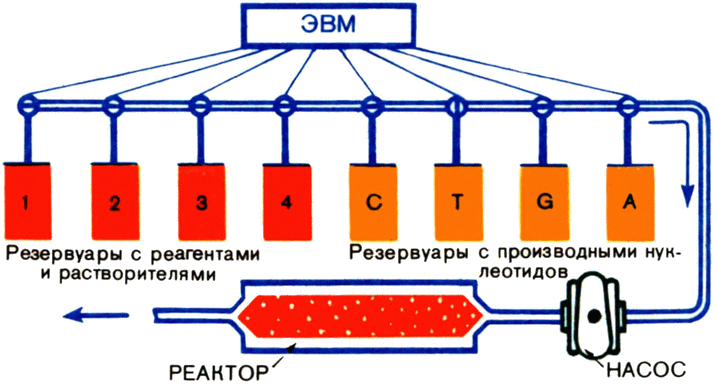 |
Рис. 35. Схема автоматического синтезатора олигонуклеотидов. |
| {100} |
нуклеотид, фосфатная группа которого активирована. Таким образом, этот нуклеотид готов присоединить к себе следующий. Работой автомата управляет небольшая ЭВМ (рис. 35). По ее сигналу в реактор вводят раствор второго нуклеотида со всеми необходимыми реагентами. В память ЭВМ заложена нуклеотидная последовательность синтезируемого олигонуклеотида. Поэтому она «знает», какой из четырех нуклеотидов отправить в реактор. Если, например, эта последовательность АСТТСС, то к полимерному носителю с пришитым к нему А первым будет направлен С. Произойдет образование первого динуклеотида (АС). Далее по сигналу ЭВМ все ненужные реагенты отмываются, а фосфорная группа приводится в боевое состояние — активируется. В реактор вводится Т, и все начинается сначала.
Так шаг за шагом автомат синтезирует весь олигонуклеотид. Когда синтез закончен (в нашем случае после присоединения С), ЭВМ дает сигнал снять все защитные группировки (для этого в реактор подаются необходимые реагенты), а затем и снять сам олигонуклеотид с полимерного носителя (рис. 36). После дополнительной очистки олигонуклеотид готов к употреблению.
На автоматическом синтезаторе олигодезоксирибонуклеотид длиной в 15—20 звеньев можно получить за несколько часов, а еще не так давно химик-синтетик тратил на это годы работы. Как вы уже знаете, олигонуклеотиды такой длины дают стабильные комплексы с комплементарными им участками ДНК и РНК; поэтому обычно их размеры устраивают генных инженеров. А если нужно синтезировать большой фрагмент гена или даже целый ген? И такие задачи сейчас выполнимы.
Первый синтетический ген получил знаменитый индийский ученый Г. Корана, работающий в США. Г. Корана — один из создателей современной химии нуклеиновых кислот, автор многих способов синтеза олигонуклеотидов. Ген, синтезированный Г. Кораной и его сотрудниками, по нынешним меркам невелик — около 150 нуклеотидных пар. Это ген одной из тРНК. Таким образом, он должен содержать в себе всю последовательность предшественника этой тРНК (но, конечно, в виде дезоксирибонуклеотида), к которой спереди присоединен промотор, а сзади — терминатор, т. е. сигналы начала и окончания транскрипции.
Эта работа была выполнена в конце 60 — начале {101} 70-х годов, когда только зарождались современные способы химического синтеза генов. Автоматические синтезаторы олигонуклеотидов еще не существовали; поэтому первый ген мог быть синтезирован только усилиями многих ученых: в те годы лаборатория Г. Кораны была настоящим международным центром синтетической химии нуклеиновых кислот (работали в нем и советские ученые).
Одним из главных достижений Г. Кораны было создание блочного способа синтеза длинных полинуклеотидных последовательностей. Суть его показана на рисунке 37. Мы специально привели уже знакомый вам ген
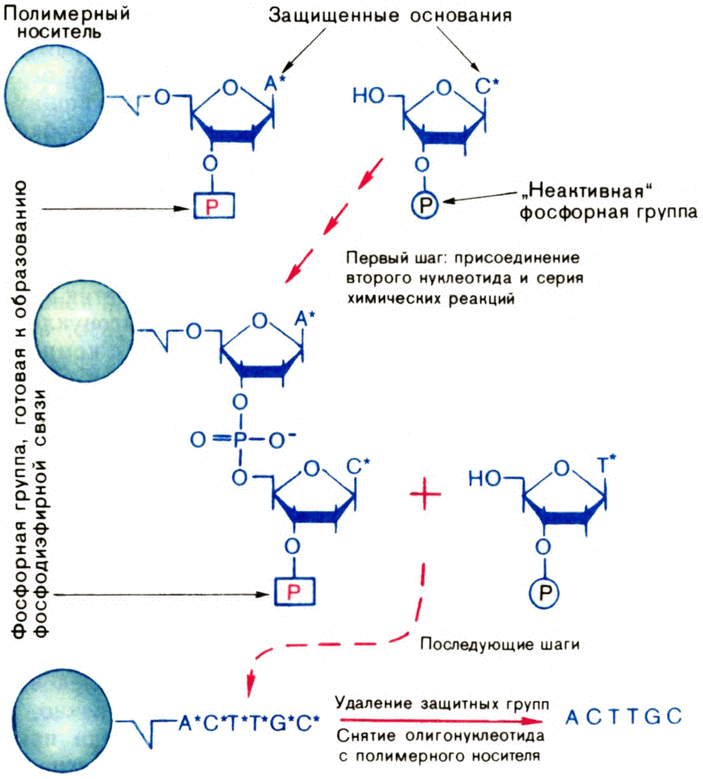 |
Рис. 36. Схема твердофазного синтеза олигонуклеотидов. |
| {102} |
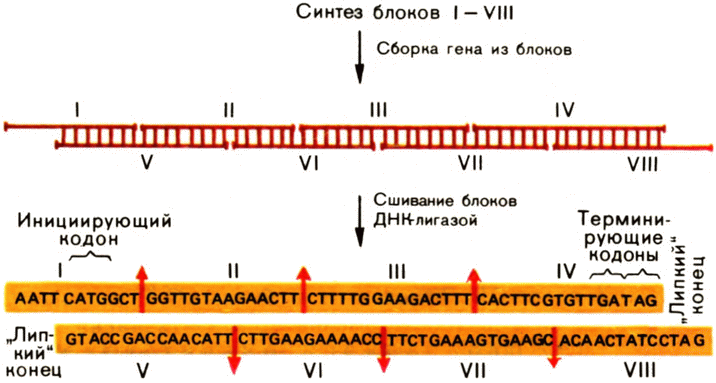 |
Рис. 37. Сборка синтетического гена гормона соматостатина. |
гормона соматостатина. Как видите, здесь опять используется принцип комплементарности нуклеиновых оснований. Каждый блок синтезируется так, чтобы его левая половина была комплементарна одному олигонуклеотиду, а правая — другому. После сборки всего гена из блоков их сшивают ДНК-лигазой. На концах синтетического гена обычно оставляют однотяжевые последовательности для встраивания его в вектор, разрезанный рестриктазами.
Блочный метод в сочетании с современными способами синтеза олигонуклеотидов позволил получить многие гены, в том числе такие большие белки, как интерфероны. Теперь химик-органик может создать наследственное вещество, что является замечательным доказательством власти современной науки над геном!
| {103} |
Есть отрасль человеческой деятельности, в которую генная инженерия вторглась в самые первые годы своего существования, — это медицина.
Болезни и наследственность. Медицина сталкивается с множеством неполадок в человеческом организме. Наиболее известны инфекционные заболевания, вызываемые бактериями (чума, холера, дизентерия, туберкулез, дифтерия и др.) и вирусами (грипп, бешенство, оспа, корь, гепатит, полиомиелит и т. д.). Сюда попадают болезни, возбудители которых низшие эукариоты, т. е. грибки и простейшие (малярия, сонная болезнь, амебная дизентерия, стригущий лишай). Иногда считают, что причина, вызывающая заболевание, внешняя — попадание в организм возбудителя, а наследственность здесь роли не играет.
Это далеко не так, вернее, совсем не так. Известно, что предрасположение к какой-либо болезни может варьировать у разных представителей рода человеческого, и это свойство наследственное. Наш замечательный этнограф и путешественник Н. Н. Миклухо-Маклай, страдавший в тропиках от тропической малярии, поражался тем, что коренные жители — папуасы — ею практически не болеют. Мы теперь знаем причину этого: у аборигенов низких широт часто встречаются аномальные гемоглобины, ядовитые для малярийного плазмодия. Следовательно, малярия, вернее способность болеть ею, — наследственная болезнь.
Вот другой пример. Вы знаете, что существуют четыре группы крови: I, II, III, IV (или О, А, В и АВ в современном обозначении). Оказалось, что люди с группой {104} крови 0 (универсальные доноры) — первые жертвы в чумной эпидемии, носители группы А чаще заболевают гриппом, АВ наиболее устойчивы к оспе. Известно, что туберкулез вызывается внешним, фактором — палочкой Коха. Это так, но... Однояйцевые близнецы имеют одинаковый генотип, и если один заболевает туберкулезом, то и другой тоже (в 87% случаев). А у генетически разнородных двуяйцевых близнецов, развивающихся из разных яйцеклеток, совпадение лишь в 25%. Муж может заразить жену (или наоборот) лишь в 7% случаев. Что же, туберкулез — наследственное или инфекционное заболевание? Пожалуй, и то и другое. Палочка Коха может развиваться в организме человека, если он к этому наследственно предрасположен.
К инфекционным заболеваниям примыкают болезни, вызываемые однократным или хроническим воздействием на организм какого-нибудь неблагоприятного внешнего фактора. Это разнообразная категория: и лучевая болезнь, и силикоз (болезнь шахтеров), и наркомания. Их объединяет то, что причина болезни вне организма, в воздействии среды. Но они не заразны.
Наоборот, есть такие болезни, которые вызываются не действием неблагоприятного фактора, а отсутствием нужного для жизни фактора. Это разнообразные авитаминозы: цинга, рахит, бери-бери и др. И здесь граница между наследственными и ненаследственными заболеваниями условна. Цинга — авитаминоз, возникающий от нехватки в организме аскорбиновой кислоты (витамина С). У человека (и у всех обезьян, а также морских свинок) не работает ген фермента α-гулоно-лактоноксидазы, превращающего глюкозу в аскорбиновую кислоту. С точки зрения собаки, мыши, крысы цинга — наследственная болезнь, которой болеют все приматы.
Все перечисленные заболевания медики относят к числу таких, которые «определяются средой, а не наследственностью». Но существуют и такие болезни, которые полностью наследуются от родителей. Обычно это генетические дефекты, мутации какого-либо гена, унаследованные от обоих родителей. К ним же относят потомки хромосом. Примерами могут быть серповидноклеточная анемия (мутантные гемоглобины не только защищают от малярии, но, к сожалению, в гомозиготном состоянии приводят к смерти в раннем возрасте); гемофилия, {105} при которой кровь не свертывается (гемофилик может погибнуть от царапины), и многие другие (всего известно свыше трех тысяч наследственных болезней). Генетический механизм расшифрован только у 10% заболеваний.
К какой категории отнести наиболее распространенные болезни, такие, как коронарная недостаточность, инфаркт, атеросклероз, инсульт, гипертония, диабет, наконец, рак? К какой категории отнести эпилепсию, нервно-психические заболевания? Их не принято считать наследственными, кроме наследственного диабета, который проявляется уже в детском возрасте. И это ошибка. Однояйцевые близнецы — точные генетические копии друг друга — отличаются удивительным совпадением (конкордантностью) в болезнях: если один из них заболевает шизофренией, то и другой в 69% случаев тоже. Конкордантность для эпилепсии у близнецов — 67%, для сахарного диабета — 65%. Дело в том, что наследственными медицина привыкла считать болезни с монофакторным наследованием, определяемые одним аллелем. Предрасположенность к инфаркту миокарда и гипертонии, нервно-психическим заболеваниям и раку также генетически определена (детерминирована), но определяется многими генами. Неудачное сочетание этих генов вызывает повышение предрасположенности, и достаточно легкого толчка извне, чтобы болезнь возникла. Все вы, наверное, знаете о случаях, когда инфаркты и приступы гипертонии возникали от «нервов», от сильных нервных потрясений. Но «порог болезни» у разных людей разный.
Старые прививки и новые вакцины. Рассмотрим на ряде примеров, что может дать (и уже дает) генная инженерная медицина. Рассмотрим инфекционные заболевания, вызываемые бактериями и вирусами. Ушли в прошлое мировые эпидемии (пандемии) чумы, холеры, оспы, от которых в средние века вымирали целые народы. Туберкулезный больной раньше редко мог надеяться на исцеление. Сейчас туберкулез и дизентерия, малярия и даже сонная болезнь, вызывавшая в Африке поголовную смертность, отступают.
Лечение и предупреждение инфекций до недавнего времени имели две основы — антибиотики и направленное стимулирование защитных сил самого организма, выработка у него иммунитета. {106}
О действии антибиотиков вы уже знаете. Рассмотрим проблемы иммунологии. Если бы люди не имели до рождения системы иммунного ответа, они умирали бы в раннем детстве от любой бактерии, как марсиане в книге Г. Уэллса «Борьба миров».
На деле любой чужеродный белок или полисахарид с молекулярной массой 10 000 и выше (такие полисахариды слагают оболочки бактерий) и некоторые другие вещества, попадая в организм позвоночного животного, вызывают иммунный ответ. Такие вещества называют антигенами. В ответ на введение антигена организм начинает синтезировать сложные белки — иммуноглобулины (более привычное их название — антитела). Эти белки соединяются с молекулами антигенов и выводят их из организма. Синтезируются антитела иммунной системой — клетками костного мозга, тимуса и лимфатической системы. Существует несколько типов иммунных клеток — иммуноцитов. Одни из них — А-клетки — только «обрабатывают» антигены для того, чтобы их «узнавали» другие, в первую очередь Т-клетки, или Т-лимфоциты, размножающиеся в вилочковой железе — тимусе (рис. 38). Различают еще В-лимфоциты — производные костного мозга. Они главные «герои» иммунного ответа и иммунологической памяти. Различают еще К-клетки (от английского killer — убийца), которые находят в организме опухолевые и зараженные вирусами клетки и растворяют их. К-клетки активируются специальным белком — интерфероном.
Как только антиген выведен из организма, концентрация антител в крови быстро начинает снижаться до минимума. Повторное введение антигена вызывает быстрый, «без раскачки», ответ. Концентрация антител стремительно возрастает, организм борется с чужими молекулами и истребляет их. Создается впечатление, что организм «помнит» старое введение антигена. Точнее, «помнят» его лимфоциты, приобретшие способность синтезировать соответствующий иммуноглобулин. Они долго могут проживать в иммунной системе, и пока они живы, организм устойчив к данному антигену.
Эта «память» приводит к тому, что человек, переболевший один раз какой-либо болезнью, вторично ею не заболевает, или она проходит у него легко, без осложнений. Иммунная система — величайшее достижение эволюции. К сожалению, не на все болезни организм
| {107} |
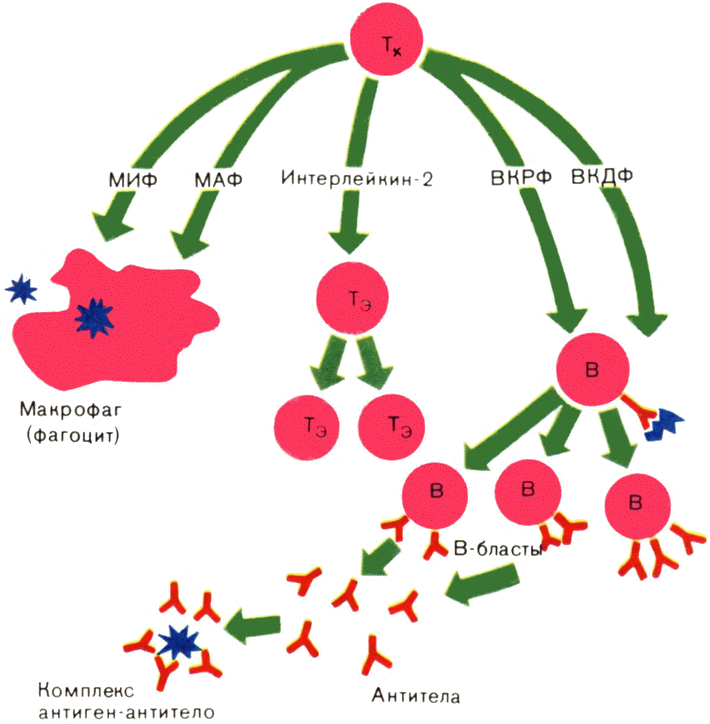 |
Рис. 38. Упрощенная схема работы системы иммунного ответа. Командное положение в ней занимают «клетки-помощники» — лимфоциты — «хелперы» (Тх), размножающиеся в тимусной железе — органе иммунитета. Именно эти клетки вырабатывают вещества, стимулирующие деятельность других лейкоцитов. Одни вещества — интерлейкины — активируют макрофаги, которые захватывают бактерии и опухолевые клетки (сокращенно МИФ и МАФ: один фактор подавляет миграцию макрофагов, второй — усиливает). Другие интерлейкины активируют тимусные эффекторные лейкоциты (Тэ), непосредственно присоединяющиеся к антигенам. Наконец, внеклеточные ростовые и дифференцирующие факторы (ВКРФ и ВКДФ) запускают в действие лимфоциты, синтезируемые в костном мозгу из предшественников В-бластов. В-клетки поставляют в кровь антитела — защитные белки-иммуноглобулины. |
| {108} |
приобретает устойчивый иммунитет. Малярией и амебной дизентерией, гриппом можно заражаться и болеть многократно. Эта система уязвима. С возрастом тимус рассасывается, и пожилые люди становятся более уязвимыми к инфекциям. Развивается она медленно, и потому грудные дети к инфекциям так же уязвимы, как и старики. Есть и вирусы, разрушающие иммунную систему, прежде всего приобретший печальную известность СПИД (синдром приобретенного иммунного дефицита, т. е. иммунной недостаточности).
Эта система «слепа» и считает антигеном и оболочку бактерии, и пересаженную почку или сердце. В таких случаях приходится подавлять иммунный ответ. Медики возлагают большие надежды на вновь открытый антибиотик циклоспорин. К сожалению, циклоспорин подавляет отторжение не только пересаженного органа, но и открывает организм для инфекций. И так действуют все подобные вещества — иммунодепрессанты.
Порой иммунная система атакует и организм ребенка, развивающегося в теле матери, и даже собственные белки организма. Это так называемая аутоаллергия. И тем не менее без этой системы жизнь была бы невозможна.
Активировать иммунную систему, не зная еще о ее существовании, впервые смог в 1798 г. английский медик Э. Дженнер. В то время черная оспа была опасной болезнью, уродовавшей и часто убивавшей людей. Известна была и сравнительно безобидная болезнь — коровья оспа, вызывавшая язвочки на вымени у коров. Доярки часто заражались ею, и Дженнер подметил, что после этого они оказывались устойчивыми к черной оспе.
Э. Дженнер предложил через царапины на предплечье заражать людей коровьей оспой. После первичного иммунного ответа человек оказывался неуязвимым к оспе человеческой, черной. Позже узнали, что аналогичную прививку на Востоке люди практиковали с незапамятных времен, но Э. Дженнер этого не знал и по праву первооткрывателя назвал эту процедуру вакцинацией (в переводе с латинского — окоровливание). Оспенные прививки быстро распространились по свету. Однако вакцина Э. Дженнера считалась хотя и выдающимся, но все же частным достижением медицины. Ни один медик не догадывался распространить этот принцип на другие инфекции. Понадобился гений великого французского {109} химика и микробиолога Луи Пастера, чтобы увидеть в прививках чудодейственное, общее для многих болезней средство. Л. Пастер понял, что введение в организм сильно ослабленных или убитых болезнетворных факторов сделает его устойчивым и к повторному заражению живыми.
Теперь это понятно: даже у убитых бактерий или вирусов сохранялись оболочечные антигены, стимулировавшие размножение лимфоцитов, синтезирующих антитела к ним. На весь мир прославило Л. Пастера изобретение прививок против бешенства. А ведь Л. Пастер не знал еще о существовании мира вирусов.
Так как вирус бешенства развивается в организме очень медленно, как и большинство вирусов, поражающих нервную систему, Л. Пастер предложил вакцинировать ослабленным вирусом людей, уже укушенных бешеным животным. Тогда антитела успевали возникнуть раньше и подавляли массовое размножение другого вируса, уже убийственного.
Впоследствии этот метод получил дальнейшее развитие. Медики научились получать концентрированные антитела на соответствующие антигены (например, на дифтерийный токсин или змеиный яд) и вводить их в кровь человеку, заболевшему дифтерией или укушенному змеей. Так появились, например, противокоревые гаммаглобулины. Их получают из донорской крови.
Донорская кровь — дорогой и малодоступный источник антител, поэтому многие из них сейчас получают из сыворотки крови животных. Начало этому положили в 1890 г. Э. фон Беринг и Т. Китасато, получив таким образом противостолбнячную сыворотку. Особенно удачно использовать для этой цели лошадей: ведь у лошади без особого вреда для нее кровь можно брать литрами. Так были получены сыворотки против дифтерийного токсина и змеиного яда. В наше время к этому старому методу добавлены лишь тонкие методы выделения нужных антител в чистом виде.
Итак, вакцинация предохраняет от болезни: в организм вводится антиген, на который вырабатывается антитело. При введение сыворотки мы лечим заболевшего, связывая попавшие в его организм антигены соответствующим антителом, заимствованным у другого человека или животного, перед тем переболевшего этой болезнью или вакцинированного против нее. {110}
Получение вакцин и иммуноглобулинов в медицине сейчас хорошо отлажено. Но генная инженерия внесла сюда свои революционные идеи.
Вакцина, вводимая в организм для выработки иммунитета, может быть мертвой или живой, т. е. содержать убитый (но сохранивший антигенные свойства) или живой, но ослабленный вирус. Живые вакцины считаются более эффективными. Недаром полученная в СССР живая вакцина детского полиомиелита завоевала весь мир, вытеснив американскую мертвую вакцину Солка. Но живые вакцины таят в себе опасность: ведь вирус в результате обратной мутации может перейти снова в активную форму. Возникла идея: получить в больших количествах чистый вирусный белок-антиген и вводить его в организм. Без нуклеиновой кислоты вирус не размножается, а мутировать чистый антиген, конечно, не может. Например, вирус бешенства содержит пять белков: большую вирусную полимеразу, белок, образующий оболочку вируса, — нуклеокапсид, матричные белки М, и М2 и гликопротеин G. Антигенной активностью обладает гликопротеин G.
Такая же ситуация наблюдается и для многих других вирусов, вызывающих опасные болезни человека. Среди многих белков, образующих оболочку этих вирусов, только один или два обладают антигенной активностью. Следовательно, для иммунизации действительно не нужен целый вирус, можно обойтись отдельными белками — субъединицами вируса. Такие вакцины так теперь и называют — субъединичными. Генная инженерия открыла простой и дешевый способ получения субъединичных вакцин. Достаточно из генома вируса (если это РНК-содержащий вирус, то используют его ДНК-копию) вырезать ген белка с антигенной активностью, встроить его в вектор и размножить этот белок в бактериальной клетке. Производство такого белка в отличие от получения вируса не только дешево, но и безопасно, а сама вакцина и безопасна, и не содержит ничего лишнего.
Субъединичные генноинженерные вакцины получены сейчас для вируса бешенства (гликопротеин G), вирусов гепатита А и ящура (так называемый белок VP1) и некоторых других. Хотя эти вакцины, несомненно, найдут применение в медицине, они, как правило, менее эффективны, чем целый вирус. {111}
Вот почему генные инженеры вспомнили о вирусе осповакцины (вирусе коровьей оспы). Этот вирус сделал огромное дело: оспа полностью ликвидирована на земном шаре и многие годы оспу перестали прививать. Однако во многих странах мира существует хорошо налаженное производство осповакцины. Поэтому были разработаны методы введения в геном вируса осповакцины любого необходимого гена и получения живых осповакцин, несущих антигены многих вирусов (о том, как это делается, мы рассказали в главе 4). Более того, в одном геноме удается объединить антигены многих вирусов, например вирусов гриппа и бешенства или вирусов герпеса и гепатита В. Вирус герпеса в латентном (неактивном) состоянии имеется в организме многих людей и часто проявляется при простуде и переохлаждении, вызывая «лихорадку на губах». Но он бывает значительно более опасным, если переселяется на слизистую оболочку глаз, к тому же считается потенциально канцерогенным, способным вызвать рак. Еще более опасен вирус гепатита. Инфекционный гепатит (болезнь Боткина) часто переходит в неизлечимый церроз, а то и рак печени. Антиген вируса гепатита В (так называемый Nbs Ag) уже получен, но вакцинация им обходится дорого. Гораздо более перспективна вакцинация вирусом коровьей оспы, в которой встроен ген Nbs Ag. Тогда антиген не надо выделять и очищать — он сам размножается в организме, создавая активный иммунитет: ведь сыворотка крови вакцинированного содержит антитела и может быть применена для лечения гепатита.
Великое достижение современной иммунологии — гибридомы (рис. 39). Лимфоциты иммунной системы человека могут размножаться в культуре и синтезировать тот иммуноглобулин, который они синтезировали в организме. Однако срок их жизни невелик. Разработаны способы слияния лимфоцитов с хорошо размножающимися в культуре раковыми клетками определенных штаммов. Продукт такого слияния — гибридома — наследует от «родителей» способности неограниченно размножаться в культуре и синтезировать строго индивидуальные антитела. Такие гибридомы — источники моно-клональных антител — разводятся биотехнологическими методами. Это один из нечастых примеров, когда в биотехнологии как источник продукта используют не быстрорастущие клетки микроорганизмов (бактерий и
| {112} |
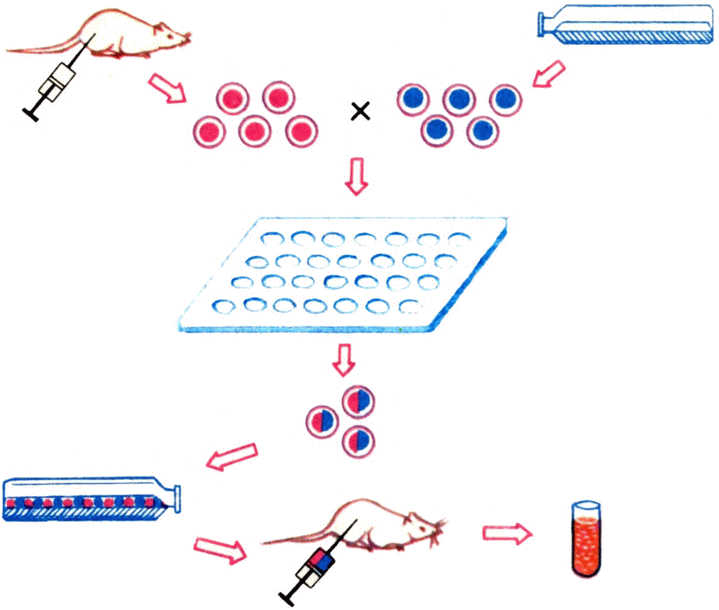 |
Рис. 39. Получение гибридомы. Мышь иммунизируют смесью белков, содержащих нужный антиген. Затем смесь лимфоцитов мыши, в которой должны быть клетки, вырабатывающие иммуноглобулин на этот антиген, смешивают со стабильными в культуре опухолевыми клетками. Под действием поли-этиленгликоля или высокочастотного электрического поля часть клеток сливается (соматическая гибридизация). Затем из массы гибридных клеток отбирают те, которые синтезируют нужный нам иммуноглобулин и клонируют их в культуре или в организме мыши-донора для получения неограниченного количества чистого, моно-клонального антитела. По прогнозам, капитал «гибридомных» фирм через 5 лет достигнет 8 млрд. долларов и в медицине произойдет небывалая по масштабам революция. |
низших грибков вроде дрожжевых), а клетки млекопитающих. Моноклональные антитела гибридом сейчас используются как очень чувствительное средство диагностики. В сочетании с радиоактивными изотопами они позволяют выявить ничтожные количества антигенов. А чем раньше поставлен диагноз, тем больше шансов на быстрое излечение болезни. Гибридомы, вернее синтезируемые ими моноклональные антитела, используются для ранней диагностики не только заразных болезней. {113} Широко известна тяжелая болезнь сердца — инфаркт, при которой повреждается сердечная мышца. Сократительный белок мышечных волокон — миозин — при этом выходит из клеток на поверхность сердца и становится доступным для антител. В США исследователи, используя гибридомы, получили моноклональные антитела на миозин, меченные изотопом индия. Это гамма-излучатель; поэтому можно получить на экране счетчика изображение поврежденной части сердца, которую «облепляют» молекулы антитела. Так появилась возможность диагностировать инфаркт у человека с сердечным приступом раньше и точнее, чем любым другим способом.
Моноклональные антитела на белки раковых опухолей, например рака прямой кишки и яичников, позволяют выявлять метастазы задолго до того, как они могут быть обнаружены по привычным для врачей клиническими симптомам. Не удивительно, что слово «гибри-дома» не сходит сейчас с уст медиков, разрабатывающих новые способы лечения и диагностики болезней.
Моноклональные антитела гибридом по всей вероятности обещают революцию в пересадке органов (почек, сердца, кожи, в будущем, возможно, печени) от человека к человеку. Иммунная система «слепа» — она накидывается и на болезнетворную бактерию, и на пересаженный орган, что становится причиной его отторжения. Врачи разработали немало иммунодепрессантов, подавляющих отторжение. Беда в том, что все время, пока они вводятся пациенту, он беззащитен от любой инфекции. Только эмбрионы млекопитающих неспособны к иммунному ответу (иначе они отторгали бы белки матери), и введенный им антиген считают «своим», даже когда у них полностью развивается система лимфоцитов. Вот если бы это явление, так называемую иммунологическую толерантность, воспроизвести у взрослого человека, которому предстоит пересадка органа!
Английским ученым Р. Бенджамену и X. Вальдманну из Кембриджа удалось это сделать пока на мышах. Методом гибридом они получили моноклональное антитело на разновидность лимфоцитов, называемых Т-хелперами. Именно они «узнают» в организме чужие белки и клетки и наводят на них другие лимфоциты и антитела, они же — мишень для вируса СПИД. У мышей с введенным антителом Т-хелперы на 12 дней исчезли из крови {114} на 90%, и им можно было вводить любой антиген.
Через 12 дней численность Т-хелперов возрастала до нормы, но организм уже считал введенный антиген «своим», не отторгал его! Дальше уже можно было не прибегать к средствам подавления иммунного ответа. Видимо, в будущем врачи вместе с пересадкой органа будут вводить больному антитело на Т-лимфоциты. После этого, конечно, недели две ему придется полежать в стерильном боксе, но это приходится делать и сейчас, после введения циклоспорина. А вновь появившиеся в крови лимфоциты пересаженного органа не заметят. Для них он «свой». В перспективе возможна пересадка человеку органа от животного другого вида.
Малярия — изнуряющая болезнь, до сих пор отравляющая жизнь большой части человечества, особенно в тропиках. Медики успешно лечат ее хинином и его производными. К сожалению, возбудитель малярии — малярийный плазмодий, хозяином и переносчиком которого являются комары из рода Anopheles, успел образовать штаммы, устойчивые к хинину. Против таких форм малярии химическая терапия бессильна. Вот если бы найти противомалярийную вакцину!
Ясно, что антигеном этой вакцины должны быть белки оболочки спорозоитов той стадии развития паразита, которая скапливается в слюнных железах комара и при укусе попадает в кровь человека. Но как получить их в достаточных количествах?
Американские исследователи из Национального института аллергологии и инфекций пошли по такому пути. Гены белка оболочки спорозоитов должны быть в составе генома и той формы паразита, которая разрушает эритроциты человека. Ее уже научились наращивать in vitro («в стекле»). Нарастив достаточное количество массы плазмодия, исследователи выделили из нее ДНК, а из той — ген, кодирующий белок с антигенными свойствами. Белок очень своеобразный: он состоит из 41 четверки (тетрапептидов) аминокислотных остатков, соединенных последовательно, причем 37 четверок одинаковы. Антигенную активность проявляет даже короткая последовательность — всего из 12 аминокислот. Клонировать ген такой последовательности (36 нуклеотидов) элементарно, легко и получить большие количества антигена. Осталось лишь проверить эффективность такой вакцины. Возможно, когда эта {115} книга попадет к вам в руки, последний этап работы будет уже проделан: поступили сведения о первых успешных опытах.
Гораздо более «твердым орешком» оказалась сонная болезнь. Ее возбудитель — жгутиковое простейшее трипаносома — переносится в Экваториальной Африке кровососущей мухой цеце. Химические препараты для лечения сонной болезни уже разработаны. Эффективен, в частности, этидий бромид, о котором мы писали в главе 3. Однако ни вакцины, ни сыворотки против сонной болезни получить не удается, и сейчас стало ясно почему. Клеточная оболочка трипаносомы слагается из белковых молекул, обладающих антигенными свойствами. Естественно, иммунная система больного синтезирует антитела, облепляющие паразитов, обитающих в крови. Но трипаносомы сбрасывают свои оболочечные антигены вместе с налипшими молекулами иммуноглобулинов и синтезируют новые, но уже другие. Новое поколение трипаносом, появляющееся в крови больного каждую неделю, имеет уже другую антигенную систему, против которой нужно заново вырабатывать иммунитет. Всего трипаносома имеет более 100 оболочечных антигенов, 100 недель она может размножаться в крови, не боясь иммуноглобулинов. За этот срок из одной трипаносомы может получиться 2100 клеток — это цифра с 30 нулями. Ясно, что больной погибает раньше, если не применить химиотерапию.
Интерфероны и вирусы. До сих пор мы говорили о синтезе антител — противобактериальных и противовирусных факторов, которые действуют строго специфично. Иммуноглобулин против кори не действует на вирус бешенства и наоборот. Но защитные системы наших организмов в принципе могут синтезировать и факторы широкого действия, блокирующие развитие многих вирусов.
Примером может быть интерферон (точнее, интерфероны). Давно подмечено, что клетки, зараженные одним вирусом, приобретают временный иммунитет к заражению другим вирусом. Это явление назвали интерференцией. Оказалось, что интерференция — сложный процесс, определяемый многими факторами, в том числе синтезом в клетке специального белка — интерферона.
Теперь известны три типа интерферонов, обозначаемые {116} первыми буквами греческого алфавита — α, β, γ. Их соответственно называют лейкоцитарными, фибробластными и иммунными. Первые два образуются в клетках при заражении вирусами и каким-то образом подавляют их развитие. Третий, γ-интерферон может блокировать рост некоторых типов злокачественных опухолей. Синтез интерферонов в организме стимулируется не только вирусами и опухолевыми клетками, но и токсинами некоторых бактерий, например стафилококков.
Интерфероны, очевидно, мощное защитное средство организма. К сожалению, они не всесильны. У многих людей, в первую очередь детей и пожилых, синтез этих защитных белков недостаточен, а это открывает ворота инфекции. Поэтому их приходится вводить в кровь больных с помощью инъекций. В аптеках бывают препараты α- и γ-интерферонов, получаемых из донорской крови (β-интерферон вырабатывается клетками соединительной ткани). Но всех обеспечить защитными белками таким путем невозможно. Слишком дорогой и дефицитный источник — человеческая кровь. Никакой другой заменить ее невозможно. Интерфероны видоспецифичны. Впрочем, как это ни странно, свиной интерферон по структуре похож на человеческий и в некоторых случаях может его заменить.
Второй источник, на этот раз фибробластного, β-интерферона, — клетки человеческой плаценты. При рождении человека отторгается плацента — те оболочки, в которых развивался зародыш в теле матери. Плацента слагается соединительной тканью. Выделенный из нее препарат с интерферонной активностью получил название плаферон; его выделили в Тбилиси и планируют внедрение в производство. Отличные стимуляторы синтеза интерферона — синтетические полинуклеотиды, образующие двойные спирали, например поли-G и поли-С. Их можно вводить в организм вместе с вакциной против вируса.
Однако самый многообещающий путь — получение генноинженерных интерферонов, для чего следует клонировать их гены в плазмидных векторах. К счастью, интерфероны не очень большие белки. Они состоят из одной полипептидной цепи длиной в 140—170 аминокислотных остатков. Кроме того, гены некоторых интерферонов просто устроены. Например, ген α-интерферона не содержит интронов. К тому же α-интерферон — негликозилированный {117} белок. Поэтому работы по клонированию генов интерферонов, проводившиеся как в нашей стране, так и в ряде зарубежных стран, очень быстро привели к замечательным результатам.
Расскажем об одной из таких работ. Она была выполнена в лаборатории Е. Д. Свердлова в Институте биоорганической химии АН СССР.
Клетки селезенки человека обрабатывали токсином стафилококка, чтобы активировать гены интерферона. Синтез в клетках начинался, естественно, с процесса транскрипции — синтеза мРНК. Далее из клеток выделяли суммарную мРНК, в которой матрица для синтеза интерферона составляла едва ли десятитысячную долю.
Затем в ход пускали обратную транскриптазу (ревертазу), способную на нити РНК синтезировать комплементарную ей ДНК (кДНК). Ее и встраивали в плазмиду кишечной палочки. Так получили тысячи клонов комплементарных ДНК, из которых требовалось отобрать нужный.
Бактерии, содержащие клоны, высевали на чашки Петри с твердой питательной средой, и после нескольких часов роста они образовывали колонии. Затем на каждую поверхность среды накладывали нитроцеллюлозный фильтр. Часть бактерий прилипала к нему, сохраняя точное расположение колоний. Теперь, если обработать фильтр раствором щелочи, клетки разрушаются, а денатурированная ДНК сорбируется на нитроцеллюлозе.
Дальнейшую работу сильно облегчило то обстоятельство, что последовательность гена γ-интерферона была уже известна. Поэтому было возможно синтезировать зонд — небольшой фрагмент этого гена — простым химическим синтезом. Этот фрагмент синтезировали «горячим», т. е. сильнорадиоактивным. Оставалось выдержать фильтры в растворе меченого фрагмента: кДНК интерферона, содержащаяся в некоторых клонах, образовывала двойные спирали с меченым фрагментом. Отмытые от лишней метки фильтры экспонировались на рентгеновской фотопленке, и везде, где имелась нужная ДНК, появлялось черное, засвеченное пятно. Зная, где расположено пятно на фильтре, нетрудно найти нужную колонию бактерий на агаре и размножить этот клон — размножить ген интерферона. На этом работа еще далеко не закончена. Следует помнить, что ген интерферона вырван из родного эукариотного генома и находится в {118} чужом окружении бактериальной клетки. К счастью, в нем уже нет интронов, с которыми «не умеют» работать бактерии: ведь он синтезирован по мРНК, из которой интроны удалены еще в клетке селезенки. Но зато к последовательности «зрелого» интерферона к нему присоединен фрагмент, в совокупности с которым он образует ген белка-предшественника. Только предшественник может выйти из клетки в плазму крови. При этом фрагмент отщепляется и белок становится активным. Этой системы созревания в кишечной палочке нет. Поэтому она может синтезировать в лучшем случае лишь неактивный предшественник, а вернее всего, транскрипции не будет: регуляторные системы, включающие гены, у бактерий другие.
К счастью, теперь уже можно наращивать клонированный ген и иметь дело не со следовыми количествами, а с целыми микрограммами (для генных инженеров такое количество считается большим).
Пришлось отщепить фрагмент, кодирующий сигнальный пептид предшественника рестриктазой Ava II, разрывающей последовательность
|
CAGGAC GTC ↑ CTG |
Правда, при этом отщепляется и часть, кодирующая «зрелый» интерферон, именно последовательность цис-тир-цис-глу. Эту последовательность из 12 нуклеотидов пришлось синтезировать химическим путем и пришить к поврежденному гену лигазой. Заодно к началу добавили кодон ATG, кодирующий метионин. Ведь у бактерий начало синтеза идет с метионинового кодона, играющего роль «заглавной буквы». Затем ДНК-лигазой присоединили элемент Р (бактериальный промотор) плюс ту коротенькую последовательность, по которой бактериальные рибосомы узнают мРНК и начинают трансляцию.
В результате всех этих сверхтонких манипуляций получился ген с липкими концами, пригодный для встройки в вектор. Результатом работы явился штамм кишечной палочки, который синтезирует человеческий интерферон до 30% суммарного белка клетки. С учетом потерь при выделении и очистке 1 л донорской крови дает примерно 1 мкг интерферона, а 1 л бактериальной взвеси — {119} в сотни раз больше! Это большая удача. Такая работа осуществлена в нашей стране и с геном α-интерферона. Его уже получают в заводских условиях под названием реоферона. Рекомбинантные интерфероны сейчас проходят клинические испытания, и будем надеяться, скоро появятся в нужном количестве в аптеках.
Интерфероны, вероятно, принесут еще немало нового. Пока неизвестно, каким образом эти чудо-белки останавливают вирусную инфекцию. Выявлено, что они стимулируют в клетках синтез непонятных олигонуклеотидов из остатков аденина, но со связями не 3'—5', как в обычных нуклеиновых кислотах, а 2'—5'! Может быть, эти олигоаденилаты «сбивают с толку» вирусные ДНК и РНК, присоединяясь к ним и блокируя дальнейшую репликацию вируса?
Интерфероны активны внутри вида (видоспецифичны). Оказалось, что человеческий интерферон подавляет рост вирусов многих растений: вируса табачной мозаики и других, и даже миковирусов шампиньонов! Сомнительно, однако, чтобы опрыскивание растений раствором интерферона, пусть даже рекомбинантного или свиного, было экономически выгодным. Но может быть, удастся встроить ген интерферона прямо в геном растения? Или для защиты растений пригодятся эти загадочные олигоаденилаты? Их относительно легко синтезировать химическими методами. Может быть, они найдут применение и в медицине? Мы об этом скоро узнаем.
Болезни, по-настоящему наследственные. Теперь перейдем к тем болезням, которые полностью, как полагают медики, определяются наследственностью.
Практически неизлечимы в наше время случаи, связанные с «поломками» хромосомного аппарата, потерей одной из хромосом в наборе (нуллисомики) или приобретением лишней (трисомики). Носители таких хромосомных мутаций нежизнеспособны или не оставляют потомства, поэтому эти мутации не накапливаются в популяциях.
Иное дело — генные мутации, затрагивающие последовательность нуклеотидов в гене. В результате возникает новый аллель, продуцирующий белок с измененными свойствами.
Разные мутации приводят к возникновению различных аллельных форм белков. Большинство из них {120} аномальны: фермент плохо ускоряет реакцию, гемоглобин хуже переносит кислород, регуляторный белок хуже выполняет свои функции. Однако сразу проявляются в фенотипе только доминантные мутации. Большинство же мутации рецессивно, а так как мы получаем от отца и матери не меньше двух одинаковых генов, они могут накапливаться в популяциях, передаваясь в скрытом виде.
Лишь когда в результате перемешивания генов в популяции человек получает и от отца, и от матери одинаково измененные гены, действие их сказывается на развитии фенотипа. Так возникают наследственные болезни. У них своя специфика. Они не принимают характера эпидемий, ими заболевают в единичных случаях. Но в государственном масштабе вред, наносимый ими, велик. В США, например, свыше 20 млн. человек (каждый десятый!) страдают унаследованными от родителей расстройствами здоровья.
Следует сказать, что некоторые наследственные болезни таковыми не считаются. Так, способность или неспособность чувствовать вкус органического соединения — фенилтиомочевины — долгое время считалась безобидной, нейтральной генетической вариацией. Теперь установлено, что у людей, которым фенилтиомочевина кажется безвкусной, чаще наблюдаются случаи зоба и кретинизма.
Первые попытки излечить наследственный дефект относились к важному гормону, управляющему углеводным обменом, — инсулину, который синтезируется поджелудочной железой. Наследственный или приобретенный дефицит инсулина приводит к тяжелой болезни — диабету, в старину называвшемуся «сахарной болезнью».
Инсулин — небольшой белок, состоящий из двух полипептидных цепочек, соединенных мостиками из двух атомов серы. Он практически не вызывает у нормальных людей реакцию отторжения, не является антигеном. Поэтому еще в начале нашего века лечили впрыскиванием раствора инсулина, выделенного из поджелудочных желез рогатого скота и свиней. Тем не менее ген инсулина теперь клонирован в кишечной палочке, и в ряде стран в продаже появился человеческий инсулин. Ведь свиной и коровий инсулин несколько отличается по составу от человеческого и у некоторых больных вызывает аллергическую реакцию. {121}
С другими гормонами белковой природы дело обстояло хуже, все они оказались видоспецифичными.
Чужим гормоном роста — соматотропином, например, нельзя лечить гипофизарный карликовый рост человека: возникает антигенная реакция.
В настоящее время клонированы гены не только человеческого соматотропина, но и его антагониста — соматостатина, который регулирует рост и управляет синтезом гормонов поджелудочной железы — инсулина и его антагониста — глюкагона. Теперь возможно не только лечить карликовый рост, но при необходимости и тормозить избыточный рост. Такие случаи отмечаются, например, при аденоме — доброкачественной опухоли передней доли гипофиза. У человека тогда начинается акромегалия: непропорционально разрастаются хрящевые концы длинных костей и челюсти. Причина акромегалии — избыточный синтез гормона роста у взрослого человека.
У нас получен человеческий соматотропин, клонированный в кишечной палочке. Он будет использоваться только для лечения карликовости, а не просто невысокого роста, что болезнью не является (рис. 40).
Один из авторов этой книги в 1982 г. получил письмо от девушки невысокого роста. Чувствуя себя не очень уютно среди современного поколения акселератов, она хотела подрасти с помощью гормонов. Напрасно я писал ей, что малый рост отнюдь не уродство, даже цитировал Р. Бернса1. Корреспондентку мою, кажется, убедили не стихи великого шотландского поэта, а опасность вместе с высоким ростом получить признаки акромегалии — патологически длинные руки и ноги и «лошадиную» челюсть.
Наоборот, сейчас ученые, например в ГДР, ставят вопрос о необходимости как-то притормозить акселерацию подрастающего поколения, хотя бы инъекциями соматостатина. Ведь двухметровые акселераты, которых становится все больше, нередко оказываются болезненными, менее устойчивыми к неблагоприятным факторам внешней среды. По-видимому, предел оптимального
| {122} |
 |
Рис. 40. Нормальная мышь (слева) и мышь, которой ввели гормон роста крысы. Гормон роста ввели следующим образом: нужный фрагмент ДНК крысы присоединили к регуляторным мышиным последовательностям и поместили в яйцеклетку мыши. Мыши с рекомбинантным геном на 20—80% крупнее обычных мышей; их называют супермышами. |
роста для мужчин около 180 см, а у женщин существенно меньше. Это только один из примеров, когда клонированные гены гормонов находят применение в медицине. Но в организме немало и других белков-регуляторов, роль которых мы только еще начинаем открывать.
Не менее интересны недавно открытые энкефалины — крошечные, всего из пяти аминокислотных остатков пептиды, по-видимому, обломки более крупных белков. К примеру у подопытных крыс эти пентапептиды улучшают память. Концентрация энкефалинов в спинномозговой жидкости у людей с нарушениями психики изменяется.
Интерес невропатологов и психиатров вызывают {123} эндорфины (эндо — «внутри», т. е. синтезируемые внутри организма морфины) — пептиды с действием, похожим на действие опиатов, т. е. таких опасных наркотиков, как морфин, опий, героин. Эндорфины синтезируются в тканях мозга. Их содержание также изменяется при психических заболеваниях. По-видимому, состояние психики человека, его душевное здоровье, зависит от равновесия концентраций эндорфинов и энкефалинов и их антагонистов. Невропатологи и психиатры полагают, что в ближайшее время в лечении нервных заболеваний произойдет революция, которую можно сравнить лишь с началом эры антибиотиков. А получить белковые факторы регуляции нервной деятельности в достаточных количествах можно только с помощью методов генной инженерии.
Новые лекарства для лечения нервных расстройств имеют большой спрос. Во второй половине XX в. ритм жизни чудовищно ускорился. Всем нам не хватаем времени, все мы спешим, порой принимаем решения наспех, а затем переживаем последствия. Слово «стресс» стало модным, все мы стремимся каким-то образом снять последствия перегрузок нервной системы. Химики разработали немало соединений, снимающих нервное напряжение, — транквилизаторов, в частности широко известный тазепам. К сожалению, транквилизаторы небезвредны, да и перестают действовать, когда организм к ним привыкает.
Физиологи нашли на оболочках нервных клеток особые белки-рецепторы, к которым присоединяются молекулы тазепама. Оказалось, что транквилизатор активирует рецептор, и в клетке начинается синтез гамма-аминомасляной кислоты, которая снимает возбуждение нервной системы. Отсюда следовало, что имеются какие-то природные аналоги транквилизаторов со сходным действием. Человек перевозбуждается просто потому, что их ему не хватает.
Американские исследователи во главе с Э. Коста попытались их найти и в конце концов получили из мозговой ткани крыс довольно крупный (105 аминокислот) пептид, практически маленький белок, который присоединялся к клеточному рецептору. Однако действие его было противоположным: он усиливал нервное возбуждение, за что получил выразительное прозвище «пептид страха». {124}
Сам по себе «пептид страха» обещает многое: ведь медицине хорошо известны случаи, когда нервная система патологически заторможена и ее нужно возбудить. Но группа Э. Коста была огорчена: они искали совсем не то. Стало ясно, что этот пептид, а вернее его активный центр из 18 аминокислотных остатков, конкурирует с искомым природным транквилизатором, присоединяясь к клеточному рецептору. Структура желанного пептида должна была быть близкой. Поэтому сотрудники Э. Коста по уже известной аминокислотной последовательности синтезировали искусственный ген «пептида страха». Гибридизуя его с ДНК человека и крысы, они «выловили» несколько генов очень сходных пептидов, которые оказались активными, способными к транскрипции, не только в мозгу, но и в других органах. Теперь дело упрощается. Можно пустить в ход весь арсенал генной инженерии и получить пептиды-антагонисты, действие которых обратно действию того, что выделен первым, т. е. «пептиду страха». Можно получить и антитело к «пептиду страха». Тогда появилась бы возможность лечить нервный стресс прививкой, как корь — коревым гамма-глобулином. Заманчивая перспектива!
Расскажем об аномальных ферментах, вызывающих унаследованные от родителей заболевания. Есть тяжелая наследственная болезнь — фенилкетонурия, при которой организм больного неспособен превращать одну из аминокислот — фенилаланин в другую — тирозин. Избыток фенилаланина приводит к ослаблению пигментации кожи и волос (тормозится синтез пигментов — меланинов). Однако не это главное. При фенилкетонурии производные фенилаланина — органические кислоты с ароматическим ядром — отравляют мозговую ткань, приводя к слабоумию. Аллель гена, вызывающий фенилкетонурию, встречается по подсчетам ученых у 0,5% населения.
Единственно надежный в настоящее время способ предотвращения фенилкетонурии — диета с предельно низким содержанием фенилаланина (полностью исключить его нельзя, так как это незаменимая для человека аминокислота). Для детей с этим наследственным дефектом ядовито даже материнское молоко — их нужно вскармливать на искусственной смеси с низким содержанием фенилаланина. Диагностировать фенилкетонурию сразу после рождения ребенка очень просто: достаточно приложить к мокрой пеленке бумажку, пропитанную {125} раствором хлористого железа — моча ребенка даст зеленую окраску.
Изготовление искусственных смесей в массовом масштабе обходится дорого. Но несравненно дороже содержание больных с тяжелыми психическими и физическими нарушениями. А если недостающий фермент вводить в кровь больному? К сожалению, инъекции малоэффективны: слишком быстро фермент разрушается в крови. Разработан иной прием. Известно, что ферменты, закрепленные на твердом носителе (иммобилизованные), более устойчивы. Исследователи предложили нужный фермент закреплять на внутренней поверхности нейлоновых трубок. Система таких трубок (реакторов) присоединяется между бедренной артерией и веной; кровь, проходящая через нее, освобождается от избыточного фенилаланина. Такие реакторы были бы очень полезны для лечения в период резкого обострения болезни. На собаках они уже испытаны. По этому пути пойдет, очевидно, медицина — до тех пор, пока генные инженеры не разработают безопасный способ включения «здоровых» генов в геном человека, т. е. пока не создадут генную хирургию.
Другой пример «больного» гена и кодируемого им «больного» фермента — ген одного из ключевых ферментов пуринового обмена у человека. Он имеет длиннейшее название: гипоксантингуанинфосфорибозилтрансфераза (сокращенно ГГФРТ). В человеческих популяциях встречаются разные аллели этого гена, продуцирующие фермент большей или меньшей активности. Чем хуже работает ГГФРТ, тем больше мочевой кислоты накапливается в организме. Наиболее «безобидный» аллель вызывает подагру (соли мочевой кислоты плохо растворимы; кристаллы их, накапливаясь в суставах, вызывают мучительные боли). Если аллель продуцирует фермент худшего качества, возникает почечно-каменная болезнь, а затем сильнейшее отравление мочевой кислотой — гиперуринемия.
Если фермент не работает совсем или ген заблокирован, наступает тяжелая болезнь. У детей, пораженных этой болезнью, сильная умственная отсталость, спинномозговые параличи. До недавнего времени такие дети были обречены. Лишь сейчас появилась надежда: Д. Миллер (США) встроил нормальный ген ГГФРТ в РНК-содержащий вирус (ретровирус) и ввел в спинной {126} мозг мышей. И там стал синтезироваться человеческий ГГФРТ! Д. Миллер предполагает приспособить вирус со встроенным геном для размножения в организме больных; к сожалению, трудность в том, что многие ретровирусы потенциально канцерогенны: встраиваясь в геном, они могут стать причиной роста злокачественной опухоли. Это уже попытка генной хирургии, попытка вставить «здоровый» ген в организм наследственно больного человека.
Больший успех пока имеют те исследователи, которые пошли по проторенному пути лечения чужим белком (т. е. человеческим, но выращенным в микроорганизме с клонированным геном). Но есть и другие пути. Мы упоминали о тяжелой наследственной болезни гемофилии, при которой у человека кровь плохо свертывается. Причина этого — отсутствие в крови полноценного белка свертываемости, так называемого фактора VIII. Это огромный белок из 2351 аминокислотного остатка, синтезируемый клетками печени. Сейчас больных гемофилией лечат введением крови доноров. Но таким путем их можно заразить вирусом гепатита или, того хуже, вирусом СПИД, о котором мы еще будем говорить. Надежнее нарабатывать в микроорганизмах чистый фактор VIII.
Недавно ген фактора VIII был отклонирован и изучен. Это самый большой из известных индивидуальных генов. Его длина — 180 тыс. пар нуклеотидов! Напомним для сравнения, что в гене интерферона всего 600 пар нуклеотидов. И тем не менее уже через 3—4 года ученые надеются создать доступный каждому больному препарат чистого фактора VIII. Особенно важно это для развивающихся стран, где продолжительность жизни больных гемофилией не превышает 20 лет. Можно и вообще избежать появления на свет больного ребенка.
Медицинские генетики дают консультации обратившимся к ним будущим матерям. В роду матери (или отца) наблюдались случаи гемофилии (или иной тяжелой наследственной болезни). Какова вероятность рождения больного ребенка в данном случае? Генетик сейчас производит нехитрые расчеты, основанные на менделевской формуле 3:1, и говорит: вероятность рождения больного, например, 25%. Слишком многое зависит от этой генетической лотереи, и воля родителей: смириться с риском или прервать беременность.
Однако методы генной инженерии позволяют со {127} 100%-ной вероятностью сказать, будет ли еще неродившийся ребенок больным или здоровым. Разработан метод дородовой диагностики. Допустим, нужно решить, несет ли в себе развивающийся в организме матери зародыш ген гемофилии. Врач берет шприцем пробу околоплодной (амниотической) жидкости, в которой до момента рождения плавает развивающийся эмбрион. В ней всегда имеются отдельные клетки зародыша, как бы «слущенные» с его поверхности. Их можно размножить на питательной среде, выделить из них ДНК и гибридизовать ее с клонированной ДНК генов «больного» и нормального. И вывод будет не вероятностным, а точным. Конечно, такой сложный анализ сейчас большинству клиник недоступен. Не хватает оборудования, реактивов, квалифицированных сотрудников, владеющих методами генной инженерии.
Генная инженерия и рак. Рассмотрим теперь, что дала генная инженерия онкологии, той отрасли медицины, которая занимается лечением больных раком, злокачественными опухолями. Этот страшный недуг, так же как и сердечно-сосудистые заболевания, сейчас вышел на первое место.
И хотя скальпель хирурга, радиоактивное излучение, химиотерапия позволяют существенно продлить жизнь больного, а в некоторых случаях практически вылечить его, окончательная победа над раком еще далека.
Что происходит в организме больного раком? Вопрос этот можно сформулировать иначе: чем клетки злокачественной опухоли отличаются от нормальных, здоровых клеток? Начнем с того, что каждая здоровая клетка может делиться строго определенное количество раз, а потом теряет способность к митозу и погибает. Опухолевые клетки обладают способностью к неограниченному росту. Именно поэтому они растут в ущерб организму больного, в конце концов приводят его к гибели и часто переживают его, разводимые в культуре, на питательной среде. Вторая особенность опухолевого роста — метастазирование: образование множественных вторичных очагов поражения — метастазов. Объясняется это тем, что отдельные клетки, отделясь от опухоли, могут мигрировать по лимфатической и кровеносной системе и размножаться в других местах, вдали от первичной опухоли.
Практически все клетки организма, способные к {128} митозу, способны и к злокачественному перерождению. Многого мы еще не знаем. Почему, например, рак молочной железы дает метастазы чаще в костную ткань? Почему селезенка, источник рака крови — лейкозов, довольно редко метастазируется сама?
Сейчас все исследователи пришли к выводу, что рак — это нарушение регуляции работы генов. К сожалению, это положение выглядит очень общим. Какой же фактор, внутренний или внешний, вызывает это нарушение регуляции? В чем заключается это нарушение?
По одной теории рак может вызываться самыми разными факторами — и внешними, и внутренними. Как проверить такую теорию экспериментом? Дело не в факторе, а в природе самой делящейся клетки. Так и пожар может возникнуть и от небрежно брошенного окурка, и от удара молнии, и самовозгорания.
По другой теории, мутагенной, рак — это соматическая мутация, не передающаяся по наследству, возникающая в соматических клетках организма. Она казалась очень вероятной, так как прием многих мутагенов вызывал у подопытных животных рост опухолей.
Еще одна, канцерогенная, теория утверждала, что разлад регуляции работы генов обусловливается канцерогенами — факторами, способными вызывать рак. Чаще всего ароматическими углеводородами и их производными, содержащимися, например, в каменноугольной смоле, асфальте, выхлопе автомобилей и табачном дыму. Она одна из первых получила подтверждение на практике: еще в старину рак кожи считался профессиональной болезнью лондонских трубочистов (камины тогда топили каменным углем). В дальнейшем оказалось, что канцерогены активно взаимодействуют с ДНК клеток, и канцерогенная теория начала сливаться с мутагенной.
Самую оригинальную, вирусно-генетическую теорию выдвинул Л. А. Зильбер, о котором мы уже писали, чей опыт, выполненный в 20-е годы, лежит в истоках генной инженерии. Согласно Л. А. Зильберу, нуклеиновая кислота вируса, включаясь в геном клетки, изменяет регуляцию генов в ней и делает клетку способной к неограниченному злокачественному росту.
Долгое время никто не верил в существование опухолеродных вирусов, хотя первые сообщения о них {129} появились еще в начале нашего века. Оригинальная гипотеза Л. А. Зильбера была подтверждена в 50-х годах американским вирусологом Р. Дальбекко, который трансформировал опухолевые клетки грызунов, заражая их обезьяньим вирусом SV-40. Многие опухоли и лейкозы оказались связанными с вирусами. Затрудняло исследователей то, что большинство этих вирусов были РНК-содержащими. Что же, РНК включается в геном, состоящий из ДНК?
Только в 1970 г. Г. Темин и Д. Балтимор открыли фермент — обратную транскриптазу (ревертазу), синтезируемый РНК-содержащими вирусами. Такие вирусы назвали ретровирусами. Ревертаза синтезирует ДНК на матрице РНК, которая может включаться в геном. За это открытие в 1975 г. оба этих ученых вместе с Р. Дальбекко были удостоены Нобелевской премии.
Вирус в РНК-вой форме может долго размножаться в клетках, не делая их злокачественными; но переходя в ДНК-содержащую форму, он может интегрироваться в геном — и последствия для организма могут быть печальными. А ДНК-вые вирусы для интеграции в геном не нуждаются в помощи ревертазы. Потенциально канцерогенными считаются многие вирусы; среди них такие распространенные, как аденовирусы. Размножаясь в клетках слизистой носоглотки, аденовирусы вызывают разнообразные болезни, которые медики называют острыми респираторными заболеваниями (ОРЗ). По крайней мере, один из четырех вирусов, вызывающих у человека бородавки, обладает онкогенной, или канцерогенной, активностью.
Все дальнейшие успехи в изучении механизма злокачественного роста неразрывно связаны с генноинженерными методами. Именно благодаря им онкология совершила блестящий прорыв в область неведомого.
Оказалось, что онковирусы содержат последовательности РНК (или соответственно ДНК), кодирующие белок, который трансформирует нормальную клетку в злокачественную. Таких последовательностей известно много. Их назвали онкогенами, а продукты их трансляции — онкобелками. Активные онкогены обнаружены во многих опухолях. Сокращенно их называют ras, myc, Blym, myb, fos и т. д. — всего более 20.
Онкоген вируса активен у саркомных вирусов, только если на концах генома имеются особые длинные
| {130} |
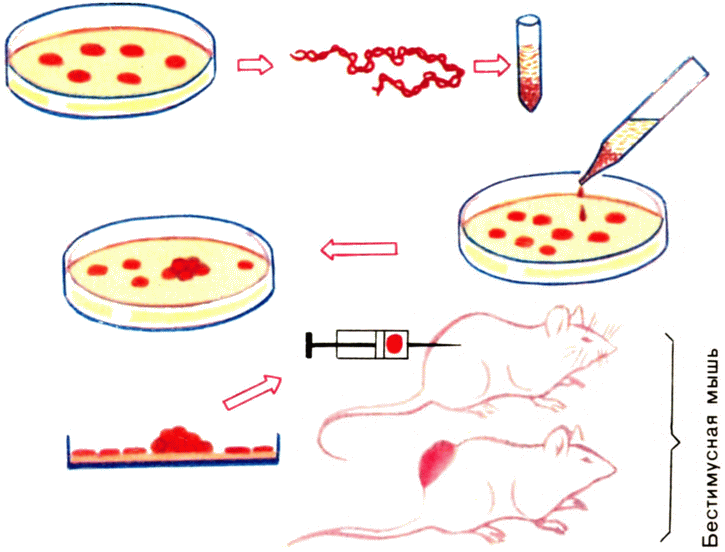 |
Рис. 41. Схема выделения онкогена. Из разводимых в культуре опухолевых клеток человека выделяют ДНК, которую затем, связанную с кристаллами гидроксиапатита, наносят на слой нормальных мышиных клеток. Если активный онкоген трансформирует клетку, в культуре возникает очаг многослойного роста. Трансформированные клетки прививают бестимусным мышам (чтобы не было отторжения), а затем выделяют онкоген из образовавшейся опухоли. |
повторы. Их назвали LTR (long terminal repeats). Сами они белков не кодируют, но без них онкоген «молчит». Чистыми онкогенами или ДНК, выделенной из опухолевых клеток, можно трансформировать нормальные клетки в злокачественные, и вероятность перерождения резко возрастает при добавке LTR (рис. 41).
Онкологи-экспериментаторы были изумлены методом молекулярной гибридизации ДНК, обнаружив онкогены в нормальных клетках всех животных — от низших червей до человека. Они получили название протоонкогенов, т. е. первичных генов рака. Название в общем бессмысленное, ведь не для вызывания рака они существуют в геноме. Что же делают протоонкогены в нормальных клетках? {131}
Оказалось, что в норме они активны лишь на определенных стадиях развития. Это было показано на эмбрионах мышей. Например, протоонкоген fos работает до стадии восьмидневного зародыша, затем его сменяет протоонкоген raski, а за ним abl. Это регуляторные гены, которые, когда не нужны, «молчат», а в период активности нарабатывают не более 20—30 молекул мРНК на клетку. Любопытно, что некоторые онко-белки по структуре похожи на факторы роста клеток. Например, онкоген вируса саркомы обезьян кодирует белок, очень похожий на фактор роста, синтезируемый в нормальных тромбоцитах, тех клетках, которые «заделывают бреши» в кровеносных сосудах.
В каких случаях протоонкоген теряет приставку «прото»? Это случается прежде всего, если к прото-онкогену присоединяется сильный промотор — вирусный LTR. Мутация самого протоонкогена также делает его сверхактивным, и это уже доказано. Одна мутация в протоонкогене ras приводит к тому, что двенадцатая аминокислота в онкобелке — лейцин — заменяется на валин, что приводит к возникновению карциномы мочевого пузыря. Хромосомные мутации, возникающие вследствие транс локации (обмен участками между негомологичными хромосомами), также приводят к тому же результату. Иногда подобные структурные перестройки внутри самого протоонкогена также его активируют. Наконец, возможна и амплификация — умножение копий онкогена.
Любопытно, что продукты разных протоонкогенов в нормальных клетках выполняют разные функции: онкобелки могут быть и ядерными, и связанными с клеточной мембраной; среди них есть и факторы роста, и ферменты. А результат их активации один: клетка приобретает способность к злокачественному, беспредельному размножению.
Новые данные имеются и о природе клеток, слагающих метастазы. По-видимому, это не простые клетки-мигранты, оторвавшиеся от первичной опухоли и приплывшие с током крови или лимфы в другое место. Иногда они разные. Например, протоонкогены myb и sis в первичных опухолях «молчат», но активируются довольно часто в метастазах.
Какая же теория происхождения рака подтвердилась? Все они оказались верными! Действительно, рак {132} может вызываться разными внутренними факторами — протоонкогенами. Активируются они в результате разных мутаций, в том числе и вызываемых внешними факторами — канцерогенами. И наконец, сверхактивный, «одичавший» онкоген может быть внесен в геном в составе вируса. Такие случаи, когда разные теории мирно сосуществуют, объединенные одной концепцией, в науке редки. Просто раньше ученые затрагивали разные стороны одной большой проблемы и полемизировали, как в восточной притче слепцы спорили, на что похож слон: на колонну, змею, хлопушку от мух или одеяло (один ощупал ногу, другой — хобот, третий — хвост, четвертый — ухо). И все были правы, но ни один до конца.
Остановимся особо на одной из форм злокачественного роста — лейкозах, когда в крови появляются в изобилии недозревшие лейкоциты, не выполняющие своих функций. Теперь описано много форм лейкозов и вирусов, которые могут их вызывать. Наиболее хорошо изучен вирус Т-клеточного лейкоза, поражающий Т-лимфоциты человека. Он известен под названием HTLV-1 (human T-ceel leucaemia virus). Впервые его обнаружили в Японии, и он сразу заинтересовал исследователей тем, что поражал тимусные лимфоциты той разновидности, которые называют Т-хелперы (от английского to help — помогать). Эти лимфоциты вырабатывают особые вещества — переносчики иммунного сигнала к другим разновидностям лимфоцитов. Эти клетки — «главный штаб» иммунной системы; их и выводит из строя вирус, вызывая злокачественное белокровие.
Похожее заболевание вскоре было обнаружено в США. Сходные ретровирусы обнаружены у обезьян Старого Света, очень близок к ним вирус лейкоза крупного рогатого скота, приносящий немалые убытки во многих странах. По-видимому, все эти вирусы — родственники. Их коварство заключается в том, что инкубационный период может длиться очень долго (десятки лет!).
К счастью, сейчас разработаны очень чувствительные иммунологические методы, позволяющие обнаружить одну молекулу вирусного антигена в 1 мл сыворотки крови. Широкое использование их в клинике позволит выявить носителей вируса и приступить к {133} лечению. К сожалению, самая страшная история впереди.
К той же группе ретровирусов относятся вирус анемии лошадей и близкий к нему вирус, вызывающий печально известный СПИД — синдром приобретенного иммунодефицита. Впервые он выявлен в США. В 1985 г. численность обнаруженных больных в этой стране превысила 13 тыс. Теперь случаи заболевания описаны для более чем 40 стран. За четыре года после диагноза 50% больных погибли от самых разных болезней. Ведь вирус СПИД, или, как его называют медики, HTLV-3, вызывает не злокачественное перерождение лимфоцитов-хелперов, а разрушает, убивает их, нанося удар в «сердце» иммунной системы. Вот почему больной беззащитен от любой инфекции и развития любой злокачественной опухоли. Люди со СПИДом болеют болезнями, совершенно не свойственными здоровому человеку, и формами опухолей, присущих ранее лишь очень пожилым людям. В строгом смысле слова СПИД нельзя назвать раком. Но вирусы Т-клеточного лейкоза и иммунодефицита крайне близки. Посмотрите на схемы строения их геномов (рис. 42). У обоих в начале и конце расположены длинные повторы — LTR. Дальше идут ген gag, кодирующий внутренние белки вирусной частицы, pol — ген ревертазы и env — ген белков оболочки (рис. 42). Различие в том, что у вируса лейкоза за env идет ген X—IV, вызывающий злокачественное перерождение лимфоцита, а у вируса СПИД после pol и env — гены Q, F, ответственные за гибель и разрушение хозяйской клетки.
Передается СПИД беспорядочными половыми связями. Наркоманы заражаются им через шприцы. А так как в США донорство платное и невыявленные носители СПИДа зарабатывают им себе на жизнь, заразиться можно и в клинике при переливании крови или введении сыворотки.
HTLV-3 — странный вирус: ведь в Центральной Африке близкий штамм его поражает и мужчин, и женщин, и детей. Там СПИД ограничен и никогда не приобретал характер эпидемии.
Перейдем к практической стороне изучения злокачественных опухолей.
Врачи давно подметили, что заражение некоторыми болезнетворными бактериями тормозит развитие
| {134} |
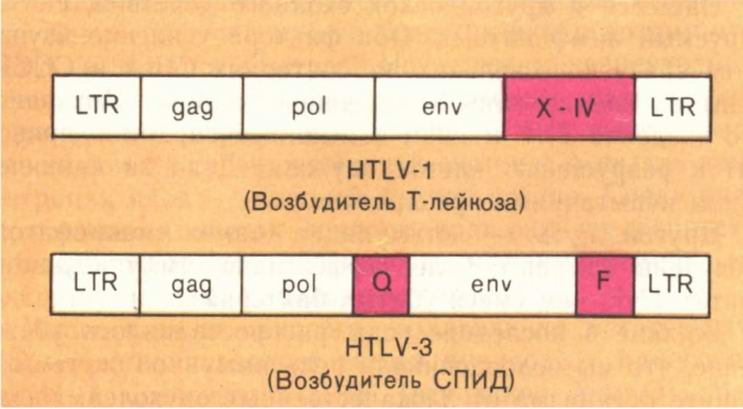 |
Рис. 42. Схема строения геномов вирусов Т-клеточного лейкоза и иммунодефицита. |
раковых клеток, вызывая иногда даже ремиссию (рассасывание) опухолей. На этом наблюдении был разработан метод лечения: больному вводили смесь убитых бактерий, например синегнойной палочки. Однако о нем забыли, когда в практику медицины вошли облучение и химиотерапия — методы гораздо более эффективные.
О старом методе вспомнили, когда выяснили, что вещества убитых бактерий не прямо действуют на клетки опухоли, а каким-то образом стимулируют клетки иммунной системы — макрофаги. Эти амебо-образные клетки, образующиеся в красном костном мозге, еще И. И. Мечников называл фагоцитами. Они заглатывают в крови и соединительной ткани, альвеолах легких и брюшной полости чужеродные клетки. Кроме того, липополисахариды убитых бактерий стимулируют в макрофагах синтез фактора, вызывающего некроз опухолей. Его и назвали по-английски TNF (tumor necrosis factor).
TNF оказался белком из 157 аминокислотных остатков. Он видоспецифичен: лишь 80% последовательности мышиного TNF гомологично человеческому. В макроцитах он синтезируется в виде белка-предшественника в 233 остатка и, лишь выходя из клетки, обретает активность. {135}
Нашелся и другой белок сходного действия, синтезируемый лимфоцитами. Оба фактора усиленно изучаются сразу в нескольких лабораториях США и СССР. Гены их клонированы в кишечной палочке. Показано, что введение TNF мышам с мышиной саркомой приводит к разрушению клеток опухоли. Дело за клиническими испытаниями препаратов.
Другой путь — стимуляция самих макрофагов. Получены факторы, более эффективно стимулирующие синтез TNF, чем смесь убитых бактерий.
Вообще в последние годы распространилось убеждение, что мы недооценивали роль иммунной системы в защите организма от злокачественных опухолей. Недаром в условиях, когда эта система ослаблена, вероятность заболеть разными формами рака возрастает. К примеру, среди 18 тыс. жителей Хиросимы, оставшихся в живых, но облученных, резко возросла заболеваемость лейкозом. Опухоли чаще наблюдаются у пожилых и у людей с врожденным иммунодефицитом. Наконец, люди с пересаженными почками и сердцами, у которых иммунное отторжение подавляется искусственно, заболевают раком значительно чаще здоровых людей.
К сожалению, как мы видим, иммунный ответ часто дает осечку и не только у пожилых людей. Опухолевые антигены обычно слабые и сильного иммунного ответа не вызывают. Мы уже говорили, что антитела на опухолевые клетки часто облепляют их и потому, меченные изотопом, используются для диагностики. Но убить вышедшую из повиновения организма клетку они не в состоянии. Поэтому в тех случаях, когда бессилен хирург и облучение не дает результатов, а также нет надежды на иммунный ответ, врачи прибегают к химиотерапии. Известны многие десятки веществ, тормозящих рост опухолей. Обычно это реактивы, подавляющие синтез нуклеиновых кислот, реже белков и других веществ, необходимых для роста клеток, в том числе и опухолевых. Современный арсенал средств химиотерапии настолько обширен, что при разумном их употреблении можно подавить рост большинства форм злокачественных опухолей и продлить жизнь больного на 5—10 лет, а то и больше.
Однако и химия не всесильна. Все разработанные ею средства отличаются малой избирательностью. Любой {136} яд, убивающий раковую клетку, опасен и для нормальной. Клетки опухоли просто более уязвимы, потому что растут и делятся быстрее. Но высокие концентрации химиотерапевтических средств применять нельзя: они будут убивать нормальные клетки — ив первую очередь опасность грозит иммунной системе! А низкие концентрации ядов — мощный фактор отбора. Среди размножающихся клеток опухоли врач-онколог попросту проводит отбор на устойчивость к применяемому им лекарству, и, как правило, с успехом.
Много надежд онкологи возлагали на метотрексат. Это вещество подавляет синтез пуринов — одного из основных компонентов ДНК (основания А и G). Метотрексат — специфический отравитель одного из ферментов, участвующих в этом процессе. В результате лечения этим препаратом опухоль прекращает рост, рассасывается. Но победу праздновать рано. Допустимые в клинике дозы метотрексата отбирают в опухоли устойчивые клетки. Лекарство теряет эффективность, а устойчивая опухоль опять начинает расти. Повысить дозу метотрексата нельзя, она и так на пределе допустимого.
Получается, что мы имеем два метода воздействия на опухоль. Один из них — активация клеток иммунной системы интерфероном или другими агентами. Лимфоциты и синтезируемые ими антитела обладают идеальной точностью наведения, специфичностью. Они атакуют только опухолевые антигены. К сожалению, их сил не хватает, чтобы расправиться с раковыми клетками.
Второй — химиотерапевтический. Вещества, применяемые в нем, могут убить раковые клетки, но они не обладают специфичностью. Вот если бы объединить оба метода, чтобы достоинства их слагались, а недостатки взаимно компенсировались! И такие методы успешно разрабатываются. Здесь снова придется вернуться к гибридомам.
Допустим, получено достаточное количество моно-клонального антитела на поверхностный антиген раковой клетки. С помощью химической модификации присоединим к молекулам антитела сильный яд и введем больному. Антитела найдут злокачественные клетки, облепят их, а яд поразит цель. Нормальные клетки останутся нетронутыми, зато средство поразит все {137} мельчайшие метастазы, притаившиеся в организме. Такие гибридные молекулы можно сравнить с боевой ракетой точного индивидуального наведения, где роль боеголовки играет токсин.
Перспективен для этой цели сильный белковый яд — токсин клещевины — рицин (той самой клещевины, из которой добывают всем известную касторку). Есть и другие вещества, не менее пригодные. В принципе, используя массированную атаку моноклональным антителом, можно подавить раковые клетки и без помощи токсина. Схема такого лечения одной из форм рака показана на рисунке 43.
Не очень трудно наладить производство гибридом для целей диагностики. Но для лечения тех же болезней моноклональных антител потребуется в тысячи раз больше! Требуется создание мощной отрасли медицинских препаратов, причем она должна не «гнать вал», а практически выполнять индивидуальные заказы
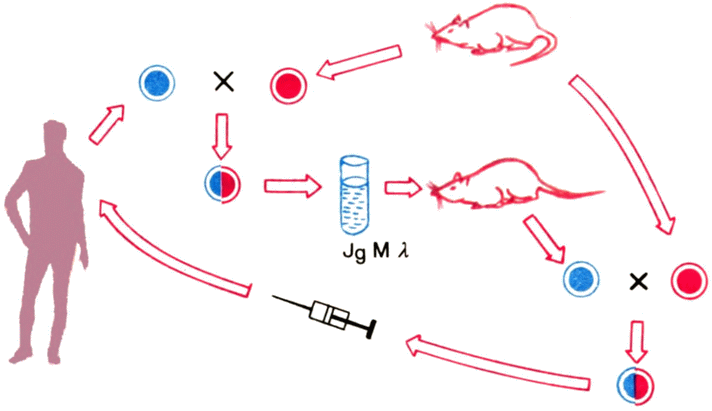 |
Рис. 43. Схема лечения человека, больного нодулярной лимфомой. При этой форме рака злокачественными становятся лимфоциты, размножающиеся в лимфатических узлах. Они вырабатывают опухолевый, дефектный иммуноглобулин Jg Mλ. Получили гибридомы опухолевых человеческих и мышиных клеток, синтезирующие в больших количествах Jg Mλ, и этим антигеном иммунизировали мышей. Из их селезенок получали уже гибридомы, вырабатывающие моноклональное антитело против Jg Mλ (иммуноглобулин против иммуноглобулина!), который вводили больному. В результате наступило длительное и стойкое улучшение (ремиссия) — практическое выздоровление. |
| {138} |
— делать антитела на разнообразнейшие белковые антигены. Сложнейшая задача!
Дело в том, что мышиные гибридомы (т. е. гибриды клеток миеломы мыши и лимфоцитов той же мыши или человека) получить легко, а сохранить трудно. Они генетически нестабильны и легко теряют хромосомы, в том числе и с геном нужного антитела. Были бы гораздо устойчивее гибридомы типа человек × человек. Но для этого необходимо найти легко гибридизующиеся и устойчивые в культуре злокачественные клетки человека. Поиски таких клеток человека (и кролика, он тоже удобнее мыши) ведутся, и получены уже первые успехи.
Онкологи и генные инженеры, вероятно, не оставят разгадку эффективного лечения рака в XXI в. Сейчас большинство сил в этой области разрабатывает «золотую жилу» онкогенов. Направление перспективное, но не следует забывать и о других подходах. Сейчас в Гарвардском университете (США) сделано важное открытие. Оказалось, что опухоль активно синтезирует регуляторный белок — ангиогенин, стимулирующий рост мелких кровеносных сосудов — капилляров. В результате опухолевые клетки пользуются интенсивным кровоснабжением, именно поэтому быстро растут!
Когда ген ангиогенина будет клонирован (а этот белок, как и всякий регулятор, эффективен при ничтожных концентрациях — до миллиономиллиардной доли грамма!), его можно будет использовать для лечения болезней, вызванных недостаточным кровоснабжением (последствия инфаркта, инсульта, ишемической болезни сердца, заживление трофических язв, язв желудка и кишечника). Еще перспективнее найти ингибитор, подавляющий синтез ангиогенина или его деятельность. Вводя такой ингибитор в опухоль, можно быстро подавить ее кровоснабжение; тогда она перестанет расти и начнет рассасываться. Сам ангиогенин — белок небольшой (123 аминокислотных остатка), его можно присоединить к моноклональному антителу и послать в нужное место организма (например, к сердцу, пораженному инфарктом). Добавим, что есть и другие оригинальные подходы к лечению злокачественных опухолей. Мы уже писали о разновидности Т-лимфоцитов — клетках-«убийцах» — киллерах. Их можно активировать и размножить в культуре. Сотрудники Национального {139} института рака (США) выделяли киллеры из ткани опухоли, удаленной во время операции, и обрабатывали иммунным гормоном — интерлейкином-2, который, как вы помните, вырабатывается клетками — хелперапи. Затем размноженные в культуре киллеры вводили в организм. Через 15 дней рассасывались опухоли толстого кишечника, метастазы в печени и легких; организм приобретал стойкий иммунитет к клеткам собственной опухоли. Правда, пока все это проделано на мышах.
По другому методу подавлялась способность опухолевых клеток перемещаться в организме, образуя метастазы. В том же институте удалось выделить из клеток меланомы человека белок — фактор миграции, повышающий подвижность клеток. В норме он полезен: под его действием клетки соединительной ткани, «сползаясь», закрывают раны (в том числе и на сердце при инфаркте миокарда). У раковых больных концентрация этого белка в крови резко повышается. Уже разрабатываются методы применения антител к фактору миграции как для ранней диагностики рака, так и для подавления способности опухоли к метастазированию. А нарощенный биотехнологическими методами этот белок обещает стать хорошим средством для быстрого заживления ран и инфарктов миокарда.
Наш обзор далеко не полный. Но мы надеемся, что читатели поймут: генноинженерные методы произвели революцию в медицине. Чтобы мы могли воспользоваться плодами этой революции, нужно активно внедрять их в практику. И не вам ли в будущем предстоит это сделать?
| {140} |
Модное слово с неясным смыслом. Слово «биотехнология» в последнее время стало очень распространенным. Тем не менее мало кто из неспециалистов представляет, что обозначает это звучное название. Порой его трактуют чересчур широко: как отрасль народного хозяйства, где производятся любые манипуляции с живыми организмами и техникой одновременно. Что же такое биотехнология в строгом смысле этого слова?
Биотехнология — это химическая бионика. Как вы знаете, бионика — это использование секретов живой природы с целью создания более совершенных технических устройств. Одно время она была очень популярна. Однако далеко не все «патенты» живой природы можно перенести в металл и пластмассу, получив при этом экономический эффект. Но два таких «патента» до сих пор вызывают жгучую зависть инженеров.
Первый из них — организация систем управления в нервной системе высших животных. Известно, что быстродействие ЭВМ намного больше, чем у нервных клеток. В ЭВМ импульс передается практически со скоростью света, в нейронах он принципиально не может идти быстрее скорости звука в водной среде. А до создания по-настоящему думающих машин, сравнимых с мозгом, еще очень далеко.
Второй — химические процессы в живых организмах. Современный инженер-химик, синтезируя то или иное вещество, применяет чаще всего высокие температуры, высокие давления, агрессивные среды (кислоты, щелочи). Отсюда неизбежны большие затраты энергии, да {141} и реакционное оборудование приходится делать из дорогих, но стойких материалов: стекла, нержавеющей стали, а то и платины.
Вот почему химики с завистью смотрят на биохимические процессы, идущие в живых организмах: с небывалой скоростью, строго направленно, без побочных продуктов, да еще и при комнатной температуре, нормальном атмосферном давлении и в нейтральной среде. Современный химик в принципе может синтезировать даже белок, но, увы, стоимость такого белка окажется в тысячи раз дороже природного.
Нельзя ли использовать биохимические процессы в промышленном производстве? Этим и занимается биотехнология. Основа ее — использование биологических катализаторов — белков-ферментов, в мягких условиях осуществляющих нужную человеку реакцию. Собственно и второе распространенное название ферментов — энзимы — пришло из биотехнологии. В прошлом веке Э. Бухнер, изучая процесс брожения, вызываемый дрожжевыми клетками, открыл, что сами клетки для гликолиза углеводов необязательны. Достаточно сока, выжатого из дрожжей. Активное начало этого сока и получило название — энзим («в дрожжах»).
Биотехнологи в подавляющем большинстве случаев используют для работ ферменты и иные биохимические системы микроорганизмов — бактерий и дрожжевых грибков. Микроорганизмы чрезвычайно быстро размножаются на искусственных средах, у них малые размеры и соответственно очень велико отношение поверхности к объему, а значит, весьма интенсивен обмен. Поэтому раньше биотехнология называлась промышленной микробиологией.
На микробиологических заводах микроорганизмы выращивают в огромных количествах. «Сердце» такого завода — ферментер — цилиндрический сосуд из нержавеющей стали, объем которого при некоторых производствах достигает нескольких десятков или даже сотен кубических метров. В ферментер подается стерильная питательная среда, в которую вносится культура микроорганизма (например, дрожжей). Содержимое ферментера интенсивно перемешивается: в него подается кислород, поддерживается температура, оптимальная для роста клеток. Специальные датчики позволяют автоматам следить за рН среды, содержанием в ней {142} различных химических веществ, ее температурой и т. д. После окончания процесса ферментации клетки отделяют от культуральной жидкости с помощью сепараторов и используют их для выделения необходимых веществ.
С незапамятных времен человек использовал свойства микроорганизмов, еще не подозревая о их существовании. Наиболее важной для примитивной древней биотехнологии была реакция гликолиза — бескислородного расщепления углеводов на углекислый газ и этиловый спирт или молочную кислоту. Люди выпекали хлеб из дрожжевого теста, изготовляли вино, пиво, уксус, кумыс, кефир, простоквашу, сыр, творог, изготовляли силос, солили капусту, огурцы — везде работала реакция гликолиза. Иные реакции использовались значительно реже (при замачивании стеблей льна, дублении кож). Эмпирически люди получали наиболее ценные штаммы нужных бактерий и дрожжей, многие из них были технологическими секретами.
Борьба за «сладкую» жизнь. Продемонстрируем успехи биотехнологии на конкретном примере, хотя бы на получении сахара. Углеводы (сахара) несколько условно можно разделить на три категории. Первая из них — моносахариды, состоящие из одной молекулы. Три моносахарида особенно важны в питании человека: глюкоза (декстроза, или виноградный сахар), фруктоза (левулеза) и галактоза (молочный сахар). Эти углеводы имеют сладкий вкус. Сладкий вкус имеют и димеры моносахаридов — дисахариды. Это лактоза (продукт соединения глюкозы и галактозы), мальтоза (глюкоза плюс глюкоза) и наиболее нам известная сахароза, или тростниковый и свекловичный сахар (глюкоза плюс фруктоза).
Но моносахариды могут полимеризоваться и дальше, образуя длинные, иногда ветвящиеся цепи полисахаридов. Если эти цепи не очень длинны, они расщепляются ферментами нашей пищеварительной системы до моносахаридов и усваиваются организмом. Это крахмал (полимер глюкозы), животный крахмал — гликоген и инулин, запасное вещество корневищ сложноцветных растений (полимер фруктозы). Все они съедобные и питательные, но не сладкие. Более длинные, содержащие свыше тысячи остатков моносахаридов, к тому же сшитые иными остатками цепи, не усваиваются организмом. Пример такого полисахарида — целлюлоза, {143} или клетчатка, слагающая клеточные стенки у растений. В чистом виде целлюлоза в природе встречается редко (волокна льна и хлопка), в древесине к ней добавляется лигнин (полимер ароматичных спиртов) и гемицеллюлозы — полимеры, содержащие другие углеводы, кроме глюкозы.
В умеренных широтах человечество всегда испытывало дефицит сладких моносахаридов и дисахаридов. Источниками их были только ягоды, фрукты и мед. Ввозимая с юга тростниковая сахароза стоила дорого, а свекловичная появилась лишь в XIX в. Моно- и дисахариды к тому же легко сбраживаются дрожжевыми грибками до этанола, в результате чего получаются опьяняющие напитки. Как превратить целлюлозу или хотя бы крахмал в глюкозу? Любопытно, что первых успехов в этом направлении первобытный человек добился, применяя биотехнологию! Можно проделать простой опыт. Пережевывайте кусочек черного хлеба как можно дольше, до получаса, и заметите, что он приобретает сладкий вкус. Это фермент амилаза, содержащаяся в слюне, расщепляет крахмал хлеба до мальтозы.
Первобытные люди долго жевали крахмальные клубни и корневища, жвачку сплевывали в сосуд и сбраживали ее — получался опьяняющий напиток.
Конечно, такой «биотехнологический» способ сейчас нельзя применять для получения сладких углеводов: он не только негигиеничен, но и нетехнологичен. В настоящее время в промышленности используется при изготовлении пива лишь амилаза, содержащаяся в проросших зернах ячменя (солоде). А как использовать огромные, до недавнего времени практически неисчерпаемые запасы целлюлозы, содержащиеся в древесине, которая не атакуется амилазой?
В 1819 г. во Франции впервые удалось расщепить на глюкозу чистую целлюлозу льна и бумаги, гидролизуя ее серной кислотой. Затем кислота нейтрализовалась мелом и оседала в виде гипса. Получался сладкий продукт — патока. Еще легче патоку было получить из крахмала. Однако сахарную проблему с помощью патоки решить не удалось. Сырье — чистая целлюлоза льна — было дороговатым, а гидролизат из древесины содержал, кроме глюкозы, еще и продукты гидролиза лигнина и годился лишь для получения гидролизного спирта и выращивания кормовых дрожжей. {144} У нас из этого спирта делали синтетический каучук, а за рубежом в смеси с бензином заправляли автомобили. Сейчас, правда, нефть подешевела, но страны, не имеющие своих месторождений, такие, как Бразилия, успешно разрабатывают это направление. Так, в Бразилии около 1 млн. автомобилей имеют двигатели внутреннего сгорания, работающие на чистом спирте, а 10 млн. автомобилей заправляются бензином, содержащим 10% этилового спирта.
В странах, богатых нефтью, большую часть этилового спирта получают в настоящее время из этилена. Химическая реакция, которая лежит в основе получения синтетического спирта, хорошо известна:
катализатор |
||
СН2=СН2+Н2O |
—————® |
СН3—СН2—ОН |
Этилен, в свою очередь, получают из нефти, запасы которой далеко не безграничны; поэтому биотехнологи всерьез думают об обратном процессе — получении этилена из этилового спирта, производимого микробиологическим путем. Ведь без этилена нельзя представить себе производство синтетических полимерных материалов и многих других ценных химических веществ.
Казалось бы, чистая технология (кислотный гидролиз) победила. Но победа была временной. Выясняя причину, почему во влажных тропиках быстро гниют хлопчатобумажные ткани, микробиологи нашли несколько видов микроскопических грибков, расщепляющих целлюлозу до растворимых, усваиваемых соединений. Грибки, поселяясь на ткани, выделяли ферменты, причем сразу несколько: одни из них расщепляли молекулы клетчатки на относительно длинные куски, другие — на димеры из двух остатков глюкозы, третьи — отщепляли по одному углеводному звену с конца молекулы. Сходные ферменты нашли у многих бактерий и актиномицетов, в том числе и у тех бактерий, которые живут в симбиозе с животными, потребляющими целлюлозу. Такие животные не столь уж редки: «белые муравьи» — термиты и ряд других насекомых, сверлящий дерево моллюск — «корабельный червь» могут питаться чистой клетчаткой, например фильтровальной бумагой. Некоторые из этих организмов — симбионтов могут усваивать атмосферный азот. Да жвачный рогатый скот: коровы, овцы, козы — могут усваивать клетчатку. Строго говоря, коровы {145} питаются не клетчаткой травы, а продуктами ее переработки — симбионтами, обитающими в их сложных желудках.
Человек, видя такой заманчивый пример, также стал «приручать» микроорганизмы, расщепляющие клетчатку. И хотя сейчас кислотный гидролиз по-прежнему широко распространен, будущее за биотехнологическими методами.
Однако какое здесь место занимает генная инженерия? Раньше промышленные микробиологи выводили ценные штаммы простым отбором и подбирали комбинацию разных видов грибков. Теперь возникает возможность соединить все нужные для полного расщепления клетчатки ферменты в одной клетке. Когда такие штаммы пойдут в производство, можно будет постепенно сворачивать производство трудоемкой культуры — сахарной свеклы. Сахаром нас обеспечат дешевые отходы лесной промышленности. Дрожжевая масса к тому же — ценный источник кормового, а в будущем и пищевого белка. Но этого мало.
Хотя мировое человечество в среднем лишь на 70% обеспечено углеводами, в развитых странах, в том числе и у нас, наблюдается их явный избыток. Строго говоря, для нормальной жизни нам вполне бы хватало углеводов хлеба и картошки. С конфетами, шоколадом, вареньем, мороженым мы получаем огромный избыток Сахаров, который в условиях гиподинамии откладывается лишней массой (вернее сказать, лишним жиром) и пользы не приносит. Конечно, геологу в маршруте или альпинисту при восхождении глюкоза необходима, но мало кто сейчас сжигает лишние калории физической нагрузкой. Есть и люди, больные диабетом, для которых избыток углеводов, в первую очередь глюкозы, смертельно опасен.
Где же выход? Отказаться от сладкого вряд ли каждый сможет. Поэтому сейчас наблюдается стремление заменять тростниковый и виноградный сахар фруктовым — фруктозой. Она значительно слаще глюкозы, и потреблять ее можно в меньших количествах. Существует специальный фермент — глюкоизомераза, трансформирующий глюкозу в фруктозу. Он уже работает в промышленности.
При нехватке сахара его раньше заменяли суррогатом — сахарином. Он не так вреден, как представляют, но и пользы не приносит. Сейчас диетологи расхваливают {146} заменители углеводов — сахарные спирты: сорбит и ксилит (первый получен из ягод рябины, второй — из дерева). Их получают, насыщая водородом соответствующие углеводы. Сорбит, например, дешевле всего получается гидрогенизацией глюкозы, а ксилит — из кукурузных кочерыжек.
Достоинства сорбита и ксилита помимо сладкого вкуса заключены в том, что они гораздо менее опасны для диабетиков, чем углеводы, широко применяются в промышленности при изготовлении самых разнообразных продуктов — от зубной пасты до взрывчатки. У ксилита есть еще одно ценное свойство: бактерии, вызывающие порчу зубов (кариес), его не усваивают; поэтому от конфет на ксилите зубы не болят.
Пока ученые не научились микробиологическим путем расщеплять лигнин древесины, пищевые продукты изготовляются из чистой целлюлозы и крахмала. Но есть микроорганизмы, потребляющие лигнин, и «приручение» их идет полным ходом.
В принципе возможны шоколад, конфеты и другие сладкие продукты, не содержащие ни глюкозы, ни фруктозы. Давно известны некоторые растения влажных тропических лесов — многолетние травы из семейства марантовых, приносящие очень сладкие плоды. Оказалось, что сладкий вкус этих плодов обеспечивают не углеводы, а белки. Известно несколько таких белков — монеллин и тауматины I и II. Тауматины в 10 000 раз слаще сахара и даже слаще сахарина, но в отличие от него безвредны. Казалось, что ничтожная добавка тауматина в пищу обеспечит «сладкую жизнь» без Сахаров. Генным инженерам удалось отклонировать ген тауматина, получить его экспрессию в бактериальных клетках и наработать этот белок в достаточных количествах. Однако выяснилось, что и тауматин далеко не идеальный заменитель сахара: он воздействует на другие вкусовые рецепторы и действие его очень длительное (после его применения во рту надолго остается сладкий вкус).
Гораздо более перспективным кажется использование аспартама — пептида, состоящего всего из двух аминокислот: аспарагиновой кислоты и фенилаланина. Добавленный в пищу в ничтожных количествах этот «сладкий пептид» полностью заменяет сахар. Разработаны как ферментативные, так и генноинженерные способы получения аспартама. Во всяком случае, биотехнологи {147} планируют, что в 1990 г. производство этого вещества в развитых странах составит уже более 10 тыс. т.
Историю борьбы за сладкие углеводы завершим рассмотрением проблемы превращения глюкозы в целлюлозу, клетчатку с помощью биотехнологии.
Вы спросите: зачем нужно такое превращение? Ведь глюкозы не хватает, а целлюлоза в избытке? Правильно, однако в древесине целлюлоза загрязнена лигнином и гемицеллюлозами.
Чистая клетчатка, образующая длинные нитевидные молекулы, содержится только в волокнах льна и хлопка. Лучше же льняных и хлопчатобумажных тканей химики пока ничего не создали. Но лен и хлопчатник трудоемкие культуры, особенно хлопчатник. В Средней Азии и Закавказье он занимает лучшую землю, отнимает большую часть воды; уборка и очистка его весьма трудоемки. Хлопкоуборочные комбайны далеки от совершенства. Прежде чем их пустить на поля, нужно с хлопчатника удалить листья дефолиантами — небезвредными веществами. Может быть, выгоднее пойти по другому пути, отказаться от возделывания этих культур?
Есть такие бактерии — ацетобактерии, сбраживающие глюкозу до уксусной кислоты. Некоторые из них способны к реакции полимеризации глюкозы в клетчатку. Из клетки такой бактерии непрерывно вытягивается тройная нить целлюлозы — за час до 100 млн. глюкозных остатков! Для примера: средняя длина молекулы целлюлозы льна составляет 30 тыс. остатков, а хлопка — всего 1500; причем и хлопок, и лен растут весь летний сезон. Целлюлозные ленты, синтезируемые бактериями, образуют на поверхности культуральной среды пленку. В подсушенном виде это прекрасный перевязочный материал, по сравнению с которым обычные бинты не идут ни в какое сравнение. Возникла идея использовать бактериальную целлюлозу в текстильной промышленности.
К сожалению, глюкоза еще слишком дорога. Чтобы ткани, созданные бактериями, вошли в практику, нужно удешевить ее раз в 100. Впрочем, если учесть что ацетобактерии можно растить на дешевом гидролизате, учесть ту прибыль, которую можно получить от высвободившейся из-под хлопчатника земли и воды, экономию на очистке сырья, то эти планы покажутся не столь фантастическими. {148}
Биотехнологи и генные инженеры пытаются гены, отвечающие за синтез целлюлозы, вставить в какие-нибудь фотосинтезирующие бактерии, которые сами вырабатывают глюкозу.
В отличие от большинства других микроорганизмов, требующих для роста сложных органических соединений, фотосинтетики используют для своей жизнедеятельности энергию солнечного света. Следовательно, для получения сверхвысококачественного текстильного сырья потребуется только солнечный свет, вода, воздух и минеральные соли. Быть может, кто-нибудь из вас решит эту задачу еще в нашем тысячелетии.
Представьте себе полностью автоматизированные заводы, стоящие где-нибудь в бесплодных пустынях, орошать которые невыгодно. Через огромные пластиковые реакторы, пронизанные солнечным светом, непрерывно прокачивается среда с бактериями. Сепараторы отделяют целлюлозу, которая направляется на прядильные фабрики. Побочным продуктом будет кормовая бактериальная масса. А на высвободившейся орошаемой земле цветут сады, растут овощи, фрукты, злаки — все то, что еще не под силу сделать биотехнологам.
А может быть, текстильщики будущего предпочтут материал лучше целлюлозных волокон? Вспомнили о прочных нитях паутины. Ведь пауки выпускают из своих желез тончайшую нить, по составу сходную с шелком тутового шелкопряда. Это тоже белок, богатый остатками аланина и глутаминовой кислоты, но прочность на разрыв доходит до 261 кг/мм2, т. е. в 6—8 раз крепче шелка! Паутинные ткани удивительно красивы, а в носке практически вечны. Но все идущие с древности попытки одомашнить пауков были неудачны. (Пауки на фермах просто пожирали друг друга, да и чем их кормить?) Теперь в Кембридже (Великобритания) генные инженеры пробуют вставить в геномы дрожжевых клеток выделенные ими гены белка паутины. Если это удастся, сверхценный текстильный материал будем получать из опилок, коры, щепок и прочих отходов деревообрабатывающей промышленности. Тогда главной продукцией лесозаводов будут паутинный шелк и кормовой белок, а доски и древесностружечные плиты — побочным продуктом.
Эволюция биотехнологии. Так на частном, хотя и важном примере мы проследили три этапа развития биотехнологии. Начало первого — древней биотехнологии {149} — уходит за тысячи лет назад, в древний каменный век. В этом периоде люди не подозревали о существовании микроорганизмов и ферментов, хотя и использовали их в своей хозяйственной деятельности.
Второй этап — этап промышленной микробиологии — начинается с середины XIX в, в первую очередь работами великого французского химика и микробиолога Луи Пастера. Люди уже знают о дрожжах и бактериях, культивируют и отбирают их полезные штаммы. Но биотехнологические методы по-прежнему применяются пока лишь в пищевой промышленности, реже в сельском хозяйстве (силосование, мочка льна).
Третий этап начинается в наше время. Биотехнология обретает свое теперешнее название. Этот период можно характеризовать следующими чертами:
1. Все чаще биотехнологи используют не сами клетки микроорганизмов, а выделенные из них ферменты. Это удобнее: нет побочных реакций, значительно облегчается стадия очистки конечного продукта.
Правда, сами по себе ферменты — вещества малоустойчивые; это белки с тонкой макромолекулярной структурой, легко разрушающейся под воздействием внешней среды. Речь, однако, идет об использовании их в качестве катализаторов промышленных процессов. Поэтому 10—15 лет назад в науке о ферментах возникло новое направление, получившее название инженерной энзимологии.
Одно из главных занятий инженеров-энзимологов — разработка методов закрепления ферментов на зернах твердого носителя. Таким носителем могут быть керамика, стекло, целлюлоза, а чаще всего синтетические полимеры. Закрепить, или, как говорят, иммобилизовать, белок на носителе можно разными способами: благодаря физической адсорбции, путем химического пришивания (образования ковалентной связи между функциональными группами белка и носителя) или посредством включения (захвата) его в полимерные гели, проницаемые для воды и низкомолекулярных веществ, но непроницаемые для белка.
Иммобилизованный фермент в десятки или даже сотни раз стабильнее фермента в растворе. Кроме того, его можно легко отделять от продуктов реакции или сам биохимический процесс вести непрерывно, прокачивая раствор реагентов, например, через колонку {150} (проточный реактор), заполненную зернами носителя с закрепленным на них ферментом. Представьте себе реакционную колонку высотой метров в пять, заполненную иммобилизованной глюкозо-изомеразой. Сверху в колонку поступает раствор глюкозы (полученный, например, при гидролизе картофельного крахмала), а снизу вытекает ценный глюкозо-фруктозный сироп.
Еще пример. Как известно, дисахарид лактоза, или молочный сахар, для большинства людей полезен. Однако некоторые взрослые люди вообще не могут пить молоко только из-за того, что содержащаяся в нем лактоза не расщепляется из-за отсутствия β-галактозидазы. В Африке этим недугом страдают целые племена. Безлактозное молоко можно легко получить с помощью иммобилизованного фермента — лактазы. Производство такого молока налажено, например, в Италии.
Развитие методов иммобилизации ферментов привело еще к одной важной находке. Оказалось, что часто вместо очищенного фермента выгоднее иммобилизовать на полимерном носителе целые клетки, производящие этот фермент. Для этого клетки микроорганизма заключают в полимерный, например полиакриламидный, гель (точно такой же, который используют для электрофореза нуклеиновых кислот), а затем кусочками этого заполняют проточные реакторы. Клетки способны многие десятки дней, а иногда и многие месяцы функционировать в таком состоянии (и даже размножаться внутри зерен геля). С помощью таких клеток — катализаторов — производят сейчас аминокислоты, антибиотики, стероидные гормоны, сахара. Их используют при очистке сточных вод, обезвреживая их от таких химических ядов, как бензол, фенолы, или даже от радиоактивных веществ.
Применяя иммобилизованные клетки, биотехнолог использует по сути дела все преимущества традиционной промышленной микробиологии и новой инженерной энзимологии. Именно здесь особенно большие надежды возлагаются на генетическую инженерию. Ведь промышленный процесс ведут не сами клетки, а фермент, который в них нарабатывается. Генная инженерия позволяет получить клетки с повышенной концентрацией необходимого фермента. Такие клетки называют сверхпродуцентами данного белка. Для этого достаточно увеличить в клетке число генов, кодирующих интересующий {151} нас биокатализатор, например, ввести в них мульти-копийную плазмиду с геном этого белка.
2. Вторая особенность современной биотехнологии — расширение ее сферы деятельности. Биотехнологическими методами сейчас изготовляются не только пищевые продукты, но и витамины, антибиотики, гормоны и ряд других лекарств, а также незаменимые аминокислоты. Производство последнего продукта имеет важное значение в животноводстве, особенно в производстве кормов для свиней и домашней птицы. Следует помнить, что организм животных не может сам синтезировать некоторые аминокислоты, он должен получать их с пищей. Человек, например, не может существовать, не потребляя триптофана, фенилаланина, лизина, треонина, вали-на, метионина, лейцина и изолейцина (ежедневно не менее 1 г каждого из них). Детям нужен еще и аргинин.
Растительные белки хлеба, картофеля, овощей и фруктов не сбалансированы по этим аминокислотам. Их там, как правило, меньше, чем в животных белках. Вот почему человек должен или потреблять большие количества того же хлеба, или добавлять в диету животный белок яиц, молока и мяса. Но свиней и кур кормить животным белком невыгодно. (У жвачных животных — рогатого скота — положение лучше: выше мы сказали, что корова, строго говоря, питается не сеном, а симбиотическими микроорганизмами, а у тех белок сбалансирован по аминокислотам.)
Выходов из этого положения два: добавлять в корм или животный белок (например, дрожжи), или незаменимые аминокислоты, недостающие в растительном корме. Второй путь выгоднее, поэтому биотехнологи работают над выведением бактерий — продуцентов лизина и триптофана. В этом случае потребление кормов резко снижается без ущерба для роста животных. Сейчас экономия растительного корма достигается чаще добавками дрожжевого белка, получаемого из гидролизата древесины и отходов сахарной и рыбной промышленности. Но производство незаменимых аминокислот перспективнее.
Рассмотрим вкратце, как генные инженеры конструируют штаммы бактерий со сверхпродукцией незаменимых аминокислот. Аминокислоты образуются в клетке вследствие очень сложного и многостадийного процесса, в котором участвуют многие ферменты. Этот {152} процесс можно схематически изобразить в виде цепочки биохимических реакций
E1 |
E2 |
E3 |
En |
||||||||
A |
→ |
B |
→ |
C |
→ |
D |
→ |
... |
→ |
N, |
где буквами А, В, С, Д,..., N обозначены продукты реакций, a E1, Е2,... и т. д. — ферменты, катализирующие образование этих продуктов.
Известно, что образование любого вещества в клетке отрегулировано очень точно. В случае образования аминокислот эта регуляция в основном осуществляется по так называемому механизму обратной связи. Поясним, что это такое. Предположим, что N — аминокислота лизин. Если в клетке синтезировалось лизина больше, чем необходимо для ее нормальной жизнедеятельности, то избыток этой аминокислоты сам подавляет свой синтез. Воздействует, однако, не на фермент Еn, а на самый первый фермент в цепи реакций, т. е. на E1, подавляет его активность и тем самым понижает уровень образования всех продуктов в цепи (В, С, Д) и т. д. Для клетки такой механизм очень экономичен: ведь если не нужен лизин, то не нужны и его предшественники.
Следовательно, чтобы сделать клетку сверхпродуцентом по лизину, необходимо растормозить реакцию А→В, сделав фермент E1 нечувствительным для лизина. А это, как вы догадываетесь, поле деятельности для белковых инженеров. Зная, на какой участок E1 воздействуют лизины, они с помощью генной инженерии произведут соответствующие изменения в гене этого белка.
Таким и сходными путями идет сейчас получение сверхпродуцентов многих незаменимых аминокислот. В нашей стране эту задачу решает большой коллектив ученых Института генетики и селекции промышленных микроорганизмов под руководством В. Г. Дебабова. В микробиологической промышленности уже несколько лет «трудится» полученный ими сверхпродуцент лизина, производящий ежегодно более 40 тыс. т этого ценнейшего продукта.
В будущем биотехнология, очевидно, освоит производство не только кормового, но и пищевого белка из микроорганизмов, растущих на дешевых отходах. Уже сейчас из такого белка получают искусственное мясо и даже черную икру — вполне доброкачественные продукты. Трудность заключается в том, чтобы научиться искусственно получать те добавки, которые делают {153} вкус этого мяса приемлемым (очищенный белок безвкусен). Добавим, что есть бактерии, хорошо растущие на нефти и природном газе — метане. Вопрос — в очистке бактериальной массы.
Приведем еще пример. Вы, наверное, знаете о стиральных порошках с ферментными добавками, которые расщепляют жиропот и прочие загрязнения. Получают их из бактериальной массы. Однако здесь есть противоречие: поверхностно-активные вещества — основа всякого стирального порошка — лучше всего работают при высокой температуре (80—90°С), а ферментные добавки в горячей воде теряют активность. Поэтому такими порошками следует стирать при 50°С, не выше. Есть, впрочем, бактерии-термофилы, хорошо себя чувствующие при температурах 90—100°С при атмосферном давлении и при 250°С — на больших глубинах океана, в подводных горячих источниках. Их ферменты: амилазы, протеазы и липазы — устойчивы и в горячей воде остаются активными. Можно было бы, конечно, выращивать на заводах термофилов, но они требуют совсем иной технологии. Фактически это означает отказаться от старых заводов и построить новые.
Английские генные инженеры нашли иной выход. Они встроили гены нужных, устойчивых к высокой температуре ферментов в геном обычной бактерии-продуцента Bacillus licheniformis, и стиральные порошки «заработали» при высокой температуре.
Биотехнология проникла даже в производство металлов. Корни биометаллургии также уходят в седую древность: первое железо было выплавлено человеком из болотных руд — продукта жизнедеятельности железобактерий, которые накапливают железо из воды, переводя его из двухвалентного в трехвалентное. Для бактерий это источник энергии, а побочный продукт — Fe2О3, оседающий на дно водоемов. Теперь биотехнология заняла прочное место в металлургической промышленности. Только в США 10% всей меди добывается микробиологическим способом; причем себестоимость ее в 2—3 раза ниже, чем стоимость меди, получаемой обычным путем. В металлургической промышленности ряда стран микроорганизмы используются для выщелачивания урана из руд, в процессе которого они из нерастворимого состояния переходят в растворимую форму. В СССР разработана технология бактериально-химического способа {154} извлечения золота и серебра из бедных этими металлами пород. Биометаллургия экономически выгодна; кроме того, она исключает загрязнение окружающей среды.
С каждым годом растет интерес к биотехнологии и со стороны нефтяников. Известно, что богатые нефтяные месторождения становятся все менее доступными. В то же время современные методы добычи позволяют извлечь из месторождения не более 40% содержащейся в нем нефти. Однако существуют микроорганизмы, разжижающие нефть или превращающие ее в газ. Есть надежда с их помощью оживить старые и уже заброшенные нефтяные месторождения в европейской части нашей страны. Имеются и первые результаты: в частности, одна из старых скважин в Башкирии (некогда богатейшее нефтью второе Баку) за полтора года с помощью микроорганизмов дала 160 тыс. т нефти. По последним данным, с помощью микроорганизмов удается каменный уголь превратить в жидкое топливо, схожее с нефтью.
3. И наконец, третья особенность современной биотехнологии — в нее широко внедряется генная инженерия. Нужные штаммы микроорганизмов теперь получаются не только отбором случайно возникающих мутаций, но и вставкой плазмид с соответствующими генами. Именно генная инженерия необычайно расширила возможности биотехнологии, позволив получать бактерии со свойствами, прежде небывалыми.
Завершим главу совсем новым примером. Генным инженерам удалось перенести в клетки кишечной палочки, продуцирующие большие количества аминокислоты триптофана, ген из другой бактерии, в котором закодирован фермент, окисляющий производные бензола. В кишечной палочке этот фермент окисляет триптофан так, что в конечном итоге образуется краситель индиго. Индиго известно людям с незапамятных времен. До конца прошлого века его вывозили из индийских колоний Англии, где краситель добывали из индигоносных растений. Потом химики придумали способ получения индиго из анилина, и синтетический краситель вытеснил природный. И вот теперь не исключено, что природный индиго (хотя и созданный при прямом участии человека) вновь вытеснит синтетический.
| {155} |
Генноинженерные методы наиболее перспективны в сельском хозяйстве, особенно в растениеводстве. Растения очень удобный объект для генных инженеров.
Клетки высших растений, в том числе и культурных, можно размножать на твердой и жидкой среде в культурах. Мы уже писали, что так теперь размножают, кроме микроорганизмов, и клетки высших животных, например человека. Наилучший эффект давали среды с экзотическими добавками, вроде молока кокосового ореха. Теперь разработаны среды дешевые и надежные, позволяющие наращивать большую биомассу растительных клеток с неизмененными свойствами. Все вы слыхали о «корне жизни» — женьшене, из которого получают чудодейственные лекарства. Оказалось, что выгоднее клетки женьшеня наращивать искусственно, в ферментерах, а не создавать плантации (и тем более искать в дальневосточной тайге).
К культивируемым растительным клеткам применимы все методы промышленной микробиологии, включая отбор клеток, интенсивно синтезирующих нужное вещество. Так были получены штаммы клеток растений раувольфии змеиной — продуцента алкалоидов, снижающих кровяное давление, руты душистой, вьюнка, наперстянки, мяты и многих других. В Японии научились растить на искусственной среде клетки шелковицы, а потом их добавлять в синтетические корма для тутового шелкопряда. Это в принципе позволяет разводить шелковичных червей где угодно, даже на Северном полюсе. Оказалось, что шелкопряды могут есть самый разнообразный корм, лишь бы от него пахло шелковицей. {156}
Но главное даже не в этом. Растительные клетки, в отличие от животных разводимые в культуре, сохраняют способность в соответствующих условиях дифференцироваться, превращаться в целое растение, которое можно потом высаживать и размножать семенами. Клетки в культуре можно сохранять в жидком азоте десятки и сотни лет, а затем превращать в целые растения и возвращать на поля. В клеточных культурах гораздо быстрее вести отбор на продуктивность, устойчивость к вредителям и отбирать нужных мутантов. Наконец, в культуры клеток очень удобно встраивать чужие гены, а затем получать растения с нужными свойствами.
Затруднение в том, что растительные клетки, как и клетки дрожжей, одеты в прочные и труднопроницаемые оболочки. Но растительную клетку, как и дрожжевую, можно «раздеть», обработав ферментами, гидролизующими целлюлозу. Так получают протопласты, доступные для внешних воздействий, например трансфекции плазмидами. Потом протопласт сам по себе восстанавливает оболочку и превращается в нормальную клетку.
Протопласты в культуре могут сливаться. Так можно гибридизовать клетки, причем не только одного вида. Гибридизуются и животные клетки: в культуре получены гибридные клетки мыши и крысы, мыши и человека и даже человека и комара. В отличие от животной единичную клетку растения можно превратить в целый организм. Так были получены гибриды разных видов табака, картофеля, томата, петунии, белладонны, моркови, сои и гороха, гороха и бобов. Но межсемейственные гибриды превратить в целые растения не удается: слишком разные геномы объединяются в гибридной клетке, поэтому таким способом нельзя вырастить «на вербе груши». К тому же такой путь не очень перспективен: как вы знаете из первой главы, кроме нужного гена, мы получаем тысячи ненужных. Перспективнее генно-инженерный путь: вставка отдельно взятого гена или системы генов, интегрированных в векторе. Культуры клеток и тканей растений открывают путь к решению сверхважной для сельского хозяйства проблемы. Ее можно выразить двумя словами: «безвирусное растениеводство».
Как освободить растения от вирусов. Растения могут поражаться многими сотнями вирусов. Обычно это {157} РНК-содержащие вирусы, хотя, как выше отмечалось, в недавнее время открыты и ДНК-вые. Не все фитовирусы убивают растение, но практически все резко снижают рост, развитие и урожайность. Особенно страдают от фитовирусов те растения, которые размножаются вегетативно — клубнями, как картофель, луковицами, как тюльпаны, черенками и прививками, как смородина и яблоня. Это понятно: перевиваемый черенок из поколения в поколение заражается разными вирусами. Убытки от фитовирусов исчисляются миллиардами.
Сравнительно простой способ получения безвирусных, здоровых растений — выращивать их из отдельно срезанных верхушечных почек, не успевших еще заразиться от старых клеток. Здесь с успехом можно применить культуры клеток и тканей. Однако как узнать, здорова клетка или она содержит вирус?
Диагностика фитовирусов разработана хорошо. В принципе она не отличается от обнаружения вирусов человека и животных. Впрыскивая кролику фитовирус, можно получить антитело на оболочечный антиген вируса. Антисыворотка на вирус — хороший, весьма чувствительный индикатор присутствия вируса в клеточном соке испытуемого растения. Современные методы иммунодиагностики с применением изотопов позволяют обнаружить вирус, если его концентрация даже менее 0,1 мкг/мл.
Чтобы получить антитела к фитовирусу, надо иметь его оболочечные антигены, т. е. выделять вирус в больших количествах. Тут и приходит на помощь генная инженерия. Ведь целый вирус нам не нужен, требуется лишь его оболочечный белок — антиген. Ген этого белка можно вставить в плазмиду и размножить в бактерии. Этот путь выгоднее, чем наращивать вирус в больных растениях граммами. Первые успехи уже имеются: в МГУ и Институте молекулярной биологии АН СССР клонированы ДНК-копии ряда генов вирусов картофеля. (Напомним, что эти вирусы содержат РНК; чтобы вставить их в геном бактерии, нужно получить кДНК ревертазой.) Так получают антигены. А для получения антител очень перспективны гибридомы, о которых мы уже говорили.
Кроме иммунодиагностики есть и другие методы обнаружения вирусов. РНК или кДНК вируса можно прямо гибридизовать с денатурированной ДНК, выделенной {158} из клетки растения. Такие методы успешно разрабатываются в МГУ, в лаборатории И. Г. Атабекова.
Что нам может дать безвирусное растениеводство? Возьмем для примера картофель. Урожайность безвирусного картофеля в 2 раза выше обычного (200 ц/га вместо средних 100 ц/га), а такая рассада вполне окупает расходы. Следовательно, можно, не снижая объема продукции, вдвое сократить площади под картофель, использовать под него рыхлые почвы, пригодные для картофелеуборочных комбайнов. Если перевести на безвирусность еще и культуры плодовых и ягодных растений, сахарной свеклы, винограда, хмеля, цитрусовых, то можно будет сказать, что получение безвирусных растений — самое важное из того, что дало культивирование клеток.
Безвирусное растениеводство нельзя свести к временной кампании, пока все вирусы не исчезнут с лица Земли. Этого придется ждать бесконечно долго: ведь многие фитовирусы поражают и культурные, и дикие растения-сорняки, а переносят их насекомые и клещи. Поэтому наряду с получением безвирусных растений генетики и генные инженеры работают над выведением новых сортов, вообще устойчивых к вирусам. Есть идея вставить в геномы растений гены интерферонов животных. Первые опыты в этом направлении уже ведутся.
Речь идет не только об интерферонах! Бельгийским ученым удалось вставить в геном табака ген токсина бациллы Бациллюс турингиензис, ядовитого для насекомых. В результате табак приобрел устойчивость к насекомым-вредителям. Значит, в будущем можно будет обойтись без инсектицидов, опасных для человека.
Азотные удобрения и сельское хозяйство. Достижения генной инженерии можно показать еще на одном очень ярком примере. В сельском хозяйстве таким примером может быть проблема фиксации атмосферного азота.
Каждая клетка человеческого организма для того, чтобы синтезировать белки, требует определенного набора готовых аминокислот. Их источником служит растительная и животная пища. Большинство растений синтезируют свои аминокислоты из простейших азотистых соединений — солей аммония и азотной кислоты, содержащихся в почве, на которой они растут. Без подходящего источника азота развитие растений становится {159} невозможным, а без растений была бы невозможной жизнь животных и человека.
Человек издревле использовал азотистые удобрения, стараясь повысить урожайность сельскохозяйственных растений. До середины XIX в. это были природные удобрения, в которых необходимые для растений азотистые вещества образуются главным образом благодаря разложению микроорганизмами остатков растительного и животного материала. В бескислородных условиях бактерии-анаэробы сбраживают органические вещества, и азот освобождается в виде аммиака и аминов; в кислородной атмосфере другие бактерии — аэробные — окисляют амины до аммиака. Часть его улетучивается, другая окисляется дальше с образованием селитр — калиевой и натриевой солей азотной кислоты.
Селитры — прекрасное азотное удобрение, но до XIX в. в Европе для этой цели их не применяли, потому что селитряных месторождений на территории Европы с ее дождливым климатом практически нет. Ведь нитраты легкорастворимы и вымываются из почвы быстрее, чем накапливаются. Но калиевая селитра — главный компонент дымного пороха, без которого немыслима была война. Селитру для пороха добывали, промывая землю из овчарен и хлевов, могильных склепов, погребов и пещер, населенных летучими мышами, — словом, из тех защищенных от дождя мест, где в почве много органических веществ.
Вот почему в Европе широкую известность приобрело открытие в Чили на побережье Тихого океана и прилегающих островах огромных залежей гуаноокаменевшего помета морских птиц, более чем наполовину состоящего из натриевой и калиевой селитр. Дожди в этих краях идут не каждый год и нитраты не вымываются. Древние инки с незапамятных времен задолго до прихода испанцев использовали гуано как удобрение, получая с его помощью богатейшие урожаи кукурузы.
Европейцы стали выделять из гуано калиевую селитру для пороха. В этом была трудность: ведь в этой породе значительно больше натриевой селитры, которая жадно впитывает влагу из воздуха, расплывается и для пороха не годится. Но изобилие гуано окупало трудности по выделению «индийской селитры» (напомним, что из-за ошибки Колумба Америку долго {160} называли Вест-Индией). Индийская, или, как теперь ее называют, чилийская, селитра была важнейшим стратегическим сырьем. Поэтому блокада молодой французской республики в 1793 г. поставила якобинскую революцию перед катастрофой: ведь для республиканской армии требовалось семнадцать миллионов фунтов селитры в год! Республиканскую, а впоследствии и наполеоновскую армии спасли от поражения ученые Г. Монж и К. Бертоле, возродившие старые способы добычи селитры из почв, богатых органикой.
В конце XIX в. интенсивное сельское хозяйство в Европе было немыслимо без чилийской селитры. Но запасы ее были не бесконечны. Пессимисты уже предсказывали истощение запасов, падение урожаев и голод. А ведь немало селитры шло и на нужды развивающейся химической промышленности, в первую очередь на получение азотной кислоты. Сама по себе селитра с появлением бездымного пороха добавлялась лишь в быстро-сгорающие его сорта (пушечный порох). Но азотная кислота оказалась незаменимым сырьем при получении как нитроцеллюлозного пороха, так и практически всех взрывчаток (нитроглицерин и тринитротолуол, мелинит и др.)- Однако потребность в азотных удобрениях перекрывала все прочие нужды.
Интересно, что над каждым гектаром посевов, страдающих от недостатка азотистой пищи, находились практически неисчерпаемые запасы азота, потенциально способные снабжать эти посевы в течение многих миллионов лет. Действительно, в атмосфере Земли, на 78% состоящей из азота, содержится около 4- 1015 т этого драгоценного элемента. Над каждым гектаром почвы на нашей планете поднимается столб воздуха, содержащий 80 тыс. т азота!
Однако ни одно высшее зеленое растение на Земле неспособно само по себе превратить этот азот в асиммилированную форму. Перед химиками встала задача разработки промышленного способа фиксации азота атмосферы и превращения его в производные аммиака и азотной кислоты. Теория подсказывала, что выгоднее всего связывать азот с водородом, получая аммиак. Соли аммония и раствор аммиака в воде сами по себе хорошее удобрение, а окисляя NH3, можно получать и селитру. {161}
Впервые процесс получения аммиака путем восстановления азота воздуха водородом
N2 + 3H2 ® 2NH3
разработал в 1904—1907 гг. немецкий химик Ф. Габер. Метод Габера реализовал в производстве в 1913 г. инженер К. Бош.
Метод Габера—Боша лег в основу современной промышленности азотных удобрений. Получающийся на первом этапе из азота воздуха аммиак может быть превращен в селитру, мочевину и другие формы, усвояемые растениями.
Казалось, что проблема азотных удобрений решена. Ведь запасы азота в атмосфере неисчерпаемы. Водород для производства аммиака получают в результате простого и эффективного процесса — конверсии природного газа (метана), запасы которого также еще недавно казались неисчерпаемыми:
CH4 + H2O = CO + 3H2
СО + Н2О = СО2 + Н2
Правда, молекула атмосферного азота (N2) — крепкий «орешек». Само восстановление азота водородом приходится вести в довольно жестких условиях — при температуре 450—550°С и давлении 300 атмосфер. И даже эти температура и давление оказались бы недостаточными, если бы не предложенный Ф. Габером катализатор, ускоряющий реакцию, — губчатое железо с добавками окислов калия и алюминия. Катализатор делал энергоемкий процесс связывания азота выгодным до тех пор, пока цены на нефть были низкими.
Однако неумеренное применение азотных удобрений вызвало к жизни новую серьезную проблему. Их эффективность оказалась неожиданно низкой. Вспомним, что нитраты легкорастворимы. Как правило, не меньше половины внесенных в почву селитр вымывается дождями и накапливается в водоемах. Это приводит к «цветению» прудов и озер: в них бурно развиваются микроскопические водоросли, отчего вода становится похожей на зеленые щи. Рыба в таких прудах гибнет. К тому же соли азотной кислоты в высоких концентрациях канцерогенны. С незапамятных времен в колбасы и ветчину добавляли селитру для того, чтобы мясо обрело красивый розовый цвет. Теперь такие добавки категорически запрещены. Кроме того, химические удобрения влияют отрицательно {162} на сообщества почвенных микроорганизмов и в конечном счете вызывают эрозию почв и снижение плодородия. Однако все эти неприятности оказались мелкими в сравнении с тем, что произошло в последние годы.
В 1970-х годах по всем капиталистическим странам прокатился энергетический кризис, отразившийся на всей мировой экономике. Цены на нефть и природный газ фантастически возросли, а это нанесло тяжелый удар по всем энергоемким производствам. Фиксация атмосферного азота относится к этой категории. Возросшая цена на удобрения немедленно отразилась на ценах пищевых продуктов.
Проблема интенсификации сельского хозяйства стала главной проблемой, стоящей перед человечеством. И немаловажную роль в ней играет расширение производства связанного азота.
Следует сказать, что после Ф. Габера и К. Боша химики не прекратили поиски более дешевых способов фиксации атмосферного азота. Не так давно советские химики М. Е. Вольпин, Б. В. Шур, А. Б. Шилов и их сотрудники открыли новые реакции молекулярного азота с комплексными соединениями переходных металлов, таких, как железо, молибден, титан, ванадий, хром. Есть надежда с помощью этих реакций превращать азот в усваиваемые растениями соединения при низких температурах и давлениях. А это резко снизит энергетические затраты. Но этот путь не единственный. Настало время вспомнить о том, что, как бы ни было велико количество вносимого в почву фиксированного химиками азота (более 400 млн. т в год во всем мире), оно составляет менее трети от того количества азота, которое связывается в природе естественным путем, т. е. живыми микроорганизмами почвы и водоемов. Рассмотрим проблему биологической фиксации азота.
Как микроорганизмы фиксируют атмосферный азот. Земледельцы давно знали, что бобовые растения не только не нуждаются в азотных удобрениях, но и обогащают почву азотом. Этот факт был установлен до открытия самого азота. Еще в Древнем Риме рачительные хозяева использовали севообороты бобовых с другими культурами. Наши крестьяне также издавна предпочитали сеять рожь и лен на клеверищах. Но причина благодатного воздействия бобовых на плодородие оставалась загадкой. И только в XIX в. ученые установили, что азот {163} из атмосферы связывают не сами бобовые, а микроорганизмы, образующие на их корнях клубеньки. Эти микроорганизмы — крупные палочковидные бактерии — впервые обнаружил в 1866 г. русский биолог М. Воронин, и лишь 22 года спустя М. Бейеринк сумел выделить их в чистом виде и вырастить в культуре.
Эти бактерии, получившие название Ризобиум, оказались капризными. В культуре они азот не связывали. Лишь в последнее время удалось установить, что Ризобиум начинает фиксировать азот, преобразуя его в аммиак, только при наличии определенных веществ — источников энергии — и при низком давлении кислорода. В клубеньках на корнях бобовых им кислород не страшен. Микробиологи выделили много чистых культур — штаммов Ризобиума. При этом оказалось, что Ризобиум гороха не образует клубеньки, например, у люпина и, наоборот, люпиновый не годится для гороха, но годится для бобов и чечевицы. Эти бактерии встречаются в почве относительно редко (менее 10 клеток на 1 г почвы), но бобовые стимулируют их развитие до 10 млн. на 1 г! Значит, выгода от сожительства высшего растения с бактерией обоюдная. Такие взаимоотношения, как вы знаете, называются симбиозом.
Оказалось, что клубеньковые бактерии-симбионты встречаются не только у бобовых. В последнее время открыто уже более 10 родов небобовых растений с азот-фиксирующими клубеньками на корнях. К ним относятся, например, всем известные ольха, облепиха и лох. За исключением одного рода, симбионты у них не относятся к роду Ризобиум, а более напоминают другую группу микроорганизмов — актиномицетов, известных как продуценты антибиотиков.
Однако растений, не способных получать связанный азот от симбионтов, все же несравненно больше. Откуда же они его берут? Ведь не везде же растут бобовые растения. На этот вопрос ответил в 1894 г. наш замечательный микробиолог С. Н. Виноградский, разработавший изящный прием выращивания бактерий на твердой среде без азота. Мы уже упоминали об этом, когда писали о селективных средах. Обычно микробиологи выращивают колонии бактерий на поверхности желатины или агара. Но эти вещества содержат связанный азот. С. Н. Виноградский использовал для своих культур гель (студень) кремневой кислоты, проще говоря, затвердевший {164} силикатный клей с добавкой Сахаров и солей. Тем самым любая колония, выросшая на этой среде, оказывалась азотфиксирующей: ведь азот она могла получать только из воздуха. Так С. Н. Виноградский открыл первую свободноживущую бактерию, способную связывать азот. Она оказалась анаэробной, живущей без кислорода, и получила название клостридиум Пастера. Род Клостридиум хорошо известен; к нему относятся, например, возбудители опаснейших заболеваний — столбняка и газовой гангрены.
С. Н. Виноградский сделал еще одно важное открытие. Ему удалось показать, что происходящее в почве окисление аммиака в нитриты (соли HNO2) и нитраты (соли HNO3) не чисто химический процесс. Селитры в природе возникают в результате жизнедеятельности особых нитрифицирующих бактерий. Одна из них, Нитрозомонас, окисляет ион аммония в ион нитрита (NO2–), а другая — Нитробактер — превращает нитрит в нитрат (NO3–). Для них реакции окисления — источник энергии. Похоже, без бактерий не обходится ни один этап превращения азота во все связанные формы.
В первом году нашего века М. Бейеринк открыл еще одного микроскопического фиксатора атмосферного азота, на этот раз аэробного, дышащего кислородом. Бактерия получила название Азотобактер. Она обогащает азотом почвы умеренного пояса. Позже выяснилось, что в кислых почвах тропиков ту же функцию выполняет другой близкий род, названный в честь М. Бейеринка — Бейеринкия.
Теперь известно немало свободноживущих микроорганизмов — фиксаторов атмосферного азота. Пожалуй, наиболее интересна из них бактерия Клебсиелла. Это близкий родственник кишечной палочки Эшерихии коли, обитающей в кишечнике каждого из нас. Кишечная палочка — один из наиболее изученных организмов на Земле. Поэтому близкая к ней Клебсиелла оказала неоценимую услугу в изучении тонких деталей механизма биологической фиксации азота.
М. Бейеринк открыл еще целую группу азотфиксаторов, так называемые сине-зеленые водоросли. Строго говоря, это не водоросли, а одна из ветвей бактерий. Правильнее их называть цианобактериями или цианофитами.
В нитчатых колониях цианобактерий встречаются {165} своеобразные клетки, практически не содержащие фото-синтезирующего пигмента. Они прозрачны и имеют толстую двухслойную оболочку — гетероцисты. Назначение гетероцист долгое время оставалось неясным, однако ученые подметили, что связывают азот только те сине-зеленые, которые образуют эти специализированные клетки. Согласно последним данным плодородие почвы обеспечивают наряду с клубеньковыми бактериями и цианобактерии, причем роль последних иногда оказывается важнее.
Некоторые цианобактерии также вступают в симбиоз с другими организмами. Вы знаете, что лишайник — симбиоз гриба и водоросли. У многих лишайников эта «водоросль» сине-зеленая, способная фиксировать азот. Поэтому они могут расти даже на оконном стекле.
Другие цианобактерии — симбионты древних тропических растений — цикадовых (тех, что неправильно называют саговыми пальмами). Агрохимиков давно занимал интересный факт. Рисовые заливные поля Южной Азии при чрезвычайно интенсивной системе хозяйства не снижают плодородия, хотя о селитре там и не слыхали. Оказалось, что рис снабжают азотом сине-зеленые, в первую очередь симбионты крошечного водяного папоротника Азоллы. Азоллу во Вьетнаме усиленно изучают; это растение, возможно, будет компонентом искусственных экологических циклов в космических кораблях. Во всяком случае, оно уже побывало в космосе вместе с В. В. Горбатко и Фам Туаном.
Итак, азотфиксаторов, как симбиотических, так и свободноживущих, к настоящему времени описано уже немало. Но все они относятся к прокариотам — организмам без оформленного ядра. Эукариоты — высшие растения, грибы, животные усваивать атмосферный азот оказались неспособными.
Выдающийся вклад в разгадку тайны фиксации атмосферного азота внесли русские и советские ученые. Еще в 1920-х годах С. П. Костычев доказал, что в основе биологического связывания азота (N2) лежит процесс восстановления его «активированным водородом органического вещества». Иными словами, в живых клетках азотфиксаторов осуществляется тот же процесс, что и в установках Габера — Боша, но при низкой температуре и атмосферном давлении!
В чем тут разгадка? Вспомните, что и 500°С температуры, {166} и 300 атмосфер давления еще недостаточны для синтеза аммиака по Габеру и приходится прибегать к катализатору — веществу, ускоряющему химическую реакцию.
С. Н. Виноградский в 1932 г. пришел к выводу, что реакция биологической фиксации азота ускоряется настолько, что становится возможной и выгодной в условиях, совместимых с жизнью, особым ферментом, который он назвал нитрогеназой.
К середине 1950-х годов было доказано, что все микроорганизмы, способные фиксировать азот атмосферы, содержат фермент нитрогеназу, который катализирует восстановление N2 в конечном итоге до NH4+. С этого момента основные усилия ученых сконцентрировались на изучении строения, механизма действия, регуляции активности и регуляции биосинтеза нитрогеназы.
Волшебная нитрогеназа. Фермент нитрогеназа — очень сложный белок. Он слагается из двух частей, получивших название компонент I и II. Компонент I, имеющий молекулярную массу 220 000, содержит от 28 до 34 атомов железа и 2 атома молибдена, поэтому его называют FeMo-белком. Компонент II меньше (молекулярная масса 60 000) и содержит 4 атома железа. Его называют Fe-белком. Оба белка содержат также большое количество серы в виде сульфидов. Эти неорганические добавки наводят на размышления. Вспомним, что в реакциях связывания азота, изучаемых М. Е. Вольпиным и А. Б. Шиловым, участвуют комплексные соединения металлов, в том числе железа и молибдена. Не пытаются ли химики-биоорганики заново создать механизм, уже реализованный природой в живых клетках азот-фиксаторов?
Компоненты I и II также сложные образования. Они состоят из более мелких субъединиц, причем каждая субъединица сложена одной полипептидной цепью и кодируется своим геном. FeMo-белок состоит из двух субъединиц одного сорта (их назвали α-субъединицами) и двух — другого (β-субъединицы). Структуру его можно написать сокращенно α2β2- Fe-белок проще, его структура α2, т. е. он состоит из двух одинаковых цепочек аминокислот (рис. 44).
Замечательно, что нитрогеназы, изолированные из любого микроорганизма, фиксирующего азот атмосферы, построены практически одинаково. Субъединицы этих
| {167} |
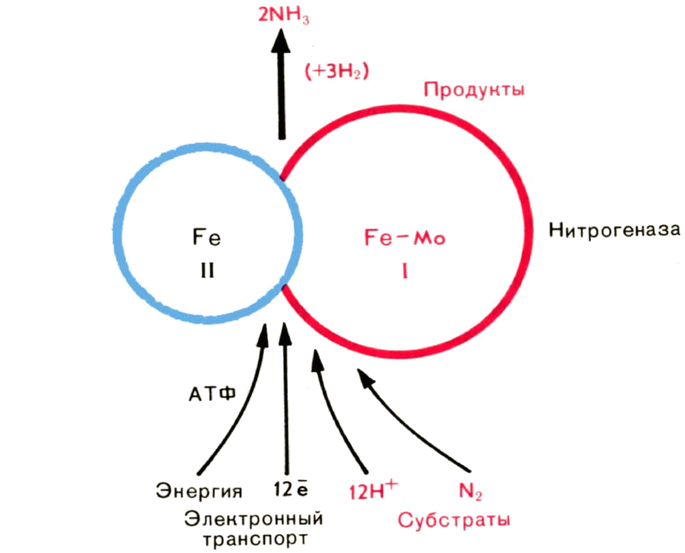 |
Рис. 44. Схема работы нитрогеназы. |
белков довольно сходны и по аминокислотной последовательности. Не удивительно поэтому, что активная нитрогеназа может быть построена из компонента I, выделенного из одного микроорганизма (например, Клебсиеллы), и компонента II, полученного из совсем другого источника (например, азотобактера).
Получение таких молекул-химер свидетельствует о многом. В первую очередь о том, что механизм биологической фиксации азота очень консервативен и возник в глубокой древности, когда первичные организмы исчерпали весь связанный азот на поверхности Земли и столкнулись с проблемой азотного голодания. С тех пор этот механизм в своих общих чертах практически не менялся.
Собственно восстановлением азота в аммиак занимается FeMo-белок. Расчеты показывают, что эта реакция должна идти в несколько стадий с образованием промежуточных продуктов, нам еще не известных. На схеме в качестве промежуточного соединения показан гидрид азота — это вполне вероятно, но еще не доказано.
Заметьте также, что, восстанавливая азот, FeMo-белок {168} отдает электроны ионам водорода (протонам), превращая их в газообразный водород. Эта важная побочная реакция, катализируемая нитрогеназой, также может найти практическое применение. Ведь водород называют топливом будущего.
Задача Fe-белка, по-видимому, сводится к тому, чтобы поставлять электроны FeMo-белку. Поэтому компонент II часто называют белком-восстановителем или редуктазой.
Нитрогеназа способна катализировать реакцию превращения (восстановления) ацетилена в этилен:
НС = СН |
Н2 |
Н2С=СН2 |
||
→ |
Это объясняется, видимо, сходством связей между атомами углерода в молекуле ацетилена и атомами азота в его молекуле
N=N
Вряд ли в природе этот процесс происходит, но для определения активности фермента реакция восстановления ацетилена оказалась очень удобной. Ацетилен хорошо растворяется в воде, а этилен плохо, поэтому легко можно отделить продукт реакции от исходного вещества и определить его количество. Теперь такие измерения проводятся даже в полевых условиях.
Как и все ферменты, нитрогеназа, несмотря на свои чудесные свойства, не может совершить невозможного: для биологического синтеза NH3 из N2 требуется энергия, львиная доля которой идет на разрыв связей в молекуле азота. Эти энергетические затраты покрываются за счет гидролиза универсального источника энергии клетки — аденозинтрифосфата (АТФ). К этой важной стороне мы еще вернемся.
Кроме нитрогеназы, в биологическом синтезе аммиака участвуют и другие белки. Все они наряду с полипептидами, слагающими FeMo- и Fe-белки, кодируются определенными генами. Эти гены называют nif-генами (от первых букв слов нитоген-фиксация). Мы уже упоминали, что способностью связывать азот обладает и близкий родственник кишечной палочки — Клебсиелла. Ее генетический аппарат детально изучен. У Клебсиеллы оказалось 17nif-генов. Они объединены в 7 групп, именуемых nif-оперонами. Продукт деятельности каждого оперона — соответствующая иРНК, на которой синтезируется белок. nif-Опероны разбросаны по единственной {169} хромосоме бактерии; между ними встроены гены, не имеющие отношения к фиксации азота.
Функции многих продуктов nif-генов сейчас известны. Так, гены nif К и nif D кодируют полипептидные цепи белков — предшественников субъединиц FeMo-белка. Гены nif В, nif N и nif E кодируют белки, которые превращают эти предшественники в нормальные α- и β-субъединицы компонента I. Белки — продукты генов nif A и nif L — заняты регуляцией активности нитрогеназы в клетке и т. д. Процесс регуляции активности nif-генов очень сложный. Так, у Клебсиеллы найдены еще три гена, не входящие в состав nif-оперона (их назвали ntr А, В и С), продукты которых регулируют активность nif А- и nif L-белков. Иными словами, они работают как регуляторы активности регуляторов.
Генетики научились «вырезать» отдельные nif-гены или целые nif-опероны из хромосомы Клебсиеллы, а также у некоторых других микроорганизмов и переносить их в хромосомы других бактерий. В клетках кишечной палочки (которая неспособна фиксировать N2) ученым даже удалось заставить на короткое время заработать нитрогеназу Клебсиеллы. А в клетках азотобактера нитрогеназа Клебсиеллы чувствовала себя совсем хорошо и работала в аэробных условиях (напомним, что сама Клебсиелла — анаэроб). Правда, перенос всех 17 nif-генов из Клебсиеллы в клетки дрожжей — простейших эукариотов — не привел к синтезу аммиака.
Располагая отдельными nif-генами Клебсиеллы, генетики сумели также определить, как эти гены организованы в хромосомах других микроорганизмов, фиксирующих азот атмосферы. При этом обнаружился интересный и практически важный факт: у Ризобиум — микроорганизмов, населяющих клубеньки на корнях бобовых растений, — nif-опероны находятся не в хромосоме, а в составе специальных крупных плазмид. В принципе можно выделять эти плазмиды и вставлять в клетки микроорганизмов, не способных к фиксации азота!
Как перенести ген в клетку растения. Возникает вопрос: если известен белок, отвечающий за фиксацию азота атмосферы, если генетики получили гены, кодирующие составляющие этого белка, то почему не перенести эти гены в клетки зеленых растений?
Прежде чем ответить на этот вопрос, мы должны задать другой вопрос: а существуют ли векторы — плазмиды {170} или вирусы, которые позволят перенести чужеродную ДНК в клетки растений? Ведь растительная клетка и по структуре клеточных стенок, и по своему внутреннему устройству так сильно отличается от бактериальной, что для нее вряд ли подойдут известные бактериальные векторы, о которых мы рассказали в предшествующих главах. Если же вирусов или плазмид, пригодных для переноса генов в растительную клетку, не найдется, сам вопрос о генной инженерии у растений отпадает.
Но и здесь все складывается, казалось бы, как нельзя лучше. Оказалось, что бактерии Агробактериум тумефациенс, обладающие давно известным свойством вызывать опухоли (так называемые галлы) у многих растений, содержат плазмиды, которые специально приспособлены к переносу генов из бактериальной в растительную клетку. Именно в этих плазмидах закодированы белки, вызывающие трансформацию нормальных клеток растений в раковые. Их называют Ti-плазмидами (Ti — tumor inducing), индуцирующими опухоли.
Обычно нормальное развитие растительной клетки регулируется специальными гормонами, так же как и развитие животной клетки. О гормонах роста животных мы уже говорили раньше. Естественно, фитогормоны имеют совсем другое химическое строение, чем соматотропин, соматостатин и другие гормоны животных. Однако функции их сходны: и те и другие стимулируют рост, развитие и специализацию одних клеток и подавляют те же процессы у других. Белки, закодированные в Ti-плазмидах, нарушают такую гормональную регуляцию, и клетки растений начинают расти бесконтрольно. Ti-плазмиды имеют очень большие размеры — около 200 тыс. пар оснований. Однако они содержат сравнительно небольшую область (13 тыс. пар оснований) так называемой Т-ДНК, которая встраивается в хромосому растительной клетки, стабильно сохраняется и функционирует в ней. Таким образом, гены, встроенные в Т-ДНК, хотя и имеют бактериальное происхождение, но уже снабжены всеми необходимыми «сигналами», обеспечивающими их работу в растительной клетке. Если встроить nif-гены в Т-ДНК Ti-плазмиды, то теоретически можно получить на растениях полезные галлы, которые будут фиксировать азот атмосферы. Такие галлы будут напоминать клубеньки на корнях бобовых растений, которые,
| {171} |
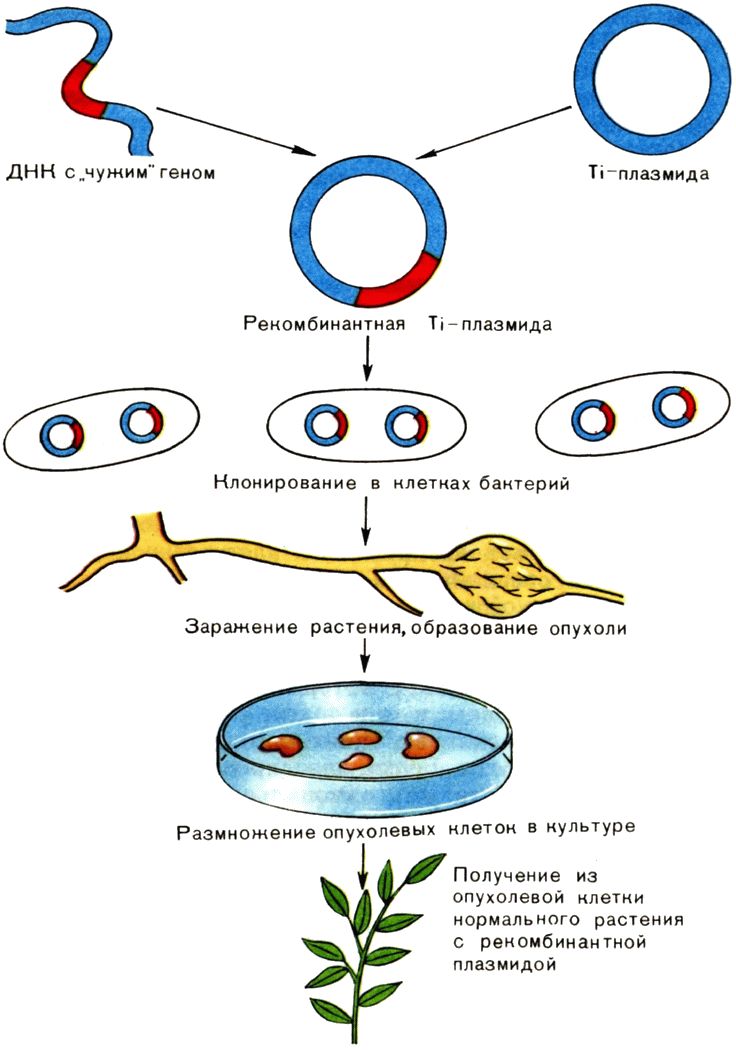 |
Рис. 45. Схема получения рекомбинантного высшего растения с помощью Ti-плазмиды. Здесь используется свойство некоторых опухолевых клеток растения образовывать нормальные растения. |
| {172} |
кстати, также относятся к растительным опухолям — галлам (рис. 45).
Из Ti-плазмиды генные инженеры уже создали удобные векторные системы для переноса чужеродных генов сначала в клетки Агробактериум, а затем с помощью этой бактерии (и второй специально сконструированной плазмиды, заранее помещенной в клетки Агробактериум) включили чужеродные гены в геном растения. Такие векторы называют бинарными (двойными), потому что они работают в паре — показано на рисунке. Обратите внимание на то, что вектор, в который встраивается чужеродный ген, — это типичный челночный вектор, т. е. он может реплицироваться как в бактериальной, так и в растительной клетке.
Бинарная векторная система с успехом использована для переноса в клетки растений признака устойчивости к антибиотику канамицину (для многих растений он ядовит). С ее помощью получены светящиеся листья табака после того, как в геном этого растения включили ген белка люциферазы, выделенный из светлячков. Ген люциферазы в генетической инженерии растений надеются использовать как маркер, подобно тому как ген β-галактозидазы (помните голубые колонии?) используют в генной инженерии микроорганизмов.
Существуют и другие способы направленного переноса в растительную клетку чужеродной ДНК. Мы писали, что недавно были открыты ДНК-содержащие вирусы растений. Это открытие сначала показалось удивительным: ведь большинство растительных вирусов содержат не ДНК, а РНК. Если генетическим путем превратить эти вирусы в непатогенные (т. е. сделать их безвредными) для растения, то они могут оказаться подходящими векторами для nif-генов.
Что мешает создать азотфиксирующее растение? К сожалению, на пути конструирования новых видов растений, фиксирующих азот атмосферы без помощи микроорганизмов, стоят очень серьезные трудности. Первая трудность состоит в том, что в растительной и бактериальной клетках действуют совершенно различные механизмы регуляции активности генов. Иными словами, процессы транскрипции (синтез РНК на ДНК) и трансляции (синтез белка) у прокариот и эукариот управляются различными сигнальными последовательностями генов и различными белками. Выход здесь {173} подсказывает изучение генома хлоропластов. Как вы знаете, хлоропласты — это обособленные органеллы растительных клеток, осуществляющие процесс фотосинтеза. Хлоропласты имеют собственный геном достаточно большого размера (от 80 до 200 тыс. пар оснований). Есть обоснованная гипотеза о том, что хлоропласты происходят от симбиотических микроорганизмов — фотосинтетиков (ближе всего к ним сине-зеленые, цианофиты). Генная инженерия эту гипотезу подтвердила. Структура генов, составляющих этот геном, хорошо изучена у многих растений. А для табака известна нуклеотидная последовательность всего генома хлоропластов (около 150 тыс. пар оснований). Анализируя строение этих генов, молекулярные биологи обнаружили в них те же сигналы транскрипции (промоторы и терминаторы) и трансляции, что и у генов бактерий. Более того, хлоропластный ген очень важного фермента — карбоксилазы (о котором мы подробнее расскажем позже) — активно работал после того, как его перенесли в клетки кишечной палочки.
Следовательно, хлоропласты — это прекрасное помещение для nif- и ntr-генов бактерий. Кстати, генные инженеры сейчас интенсивно работают над конструированием из хлоропластной ДНК векторов, которые и позволят переносить чужеродные (например, бактериальные) гены непосредственно в хлоропласты. Здесь, правда, возникает новая трудность: ведь в хлоропластах в результате фотосинтеза возникает свободный кислород, а кислород и работающая нитрогеназа несовместимы.
О другой проблеме мы уже рассказывали: биологическая фиксация азота подобно химической требует огромных энергетических затрат. В клетке эти расходы в конечном итоге покрываются за счет гидролиза АТФ. При отщеплении от АТФ одной молекулы Н3РO4 образуется адениндифосфат и выделяется энергия, потребляемая клеткой. Так, Клебсиелла расходует по разным оценкам от 12—14 до 29 молекул АТФ на превращение одной молекулы N2 в ионы аммония. А если учесть, что при работе нитрогеназы ее компонент II (Fe-белок) получает электроны от таких биологических восстановителей, как ферродоксин и флаводоксин, то на биологическую фиксацию одного моля N2 этим организмом расходуется до 40 эквивалентов АТФ. Значит, если в клетку растения или какого-то другого организма, не приспособленного {174} природой для фиксации азота атмосферы, просто ввести нитрогеназу и заставить ее работать, то это мгновенно исказит ее энергетический обмен, и клетка погибнет от аденозинтрифосфатного голода. Клетка попросту надорвется, как человек, под непосильным грузом.
Еще одна, пожалуй, более серьезная трудность заключена в свойствах самой нитрогеназы. Если этот фермент изолировать из фиксирующего азот микроорганизма, то он мгновенно инактивируется, «отравляется» кислородом воздуха. Причем водород отравляет нитрогеназу необратимо, т. е. если фермент вновь поместить в бескислородную среду, то он остается неактивным. Из этого следует, что процесс биологической фиксации азота возник, когда земная атмосфера еще не содержала кислорода. Населявшие Землю микроорганизмы были анаэробами и получали энергию за счет реакций, схожих с современным брожением, а фотосинтезирующие бактерии усваивали сероводород. Со временем сине-зеленые выработали способность при помощи солнечного света расщеплять воду и получать углеводы из образующегося при этом водорода и углекислого газа (СO2). Запасы водорода в воде оказались неисчерпаемыми, но при этом выделялся вредный побочный продукт... кислород, абсолютно ядовитый для всех тогда живущих существ! Это потом кислород стал живительным газом, когда возникло кислородное дыхание. Но все черты фиксации азота менять было уже поздно. У тех организмов, которые возникли позже, т. е. у животных и растений, этот процесс вообще не возник, а микроорганизмы-азотфиксаторы выработали сложные механизмы, защищающие нитрогеназу от кислородного отравления. Следовательно, если мы перенесем nif-гены в клетки, которые не умеют защищать нитрогеназу от кислорода, то в лучшем случае мы получим неактивный фермент, а в большинстве случаев такая клетка быстро прекратит синтез ненужного ей белка.
И наконец, еще одна трудность, с которой встретились генетики, конструирующие новые фиксирующие азот организмы, состоит в том, что ионы аммония, образующиеся при восстановлении азота, должны сразу же использоваться другими ферментативными системами для синтеза аминокислот. Если же они накапливаются в клетке в слишком больших количествах, то биосинтез {175} нитрогеназы (правда, на этот раз обратимо) подавляется. Этот механизм позволяет клеткам многих фиксирующих азот микроорганизмов связывать ровно столько атмосферного азота, сколько им необходимо для внутренних нужд. Продукт реакции, накопленный в достаточном количестве, быстро останавливает ее; поэтому ионов аммония в клетке всегда столько, сколько необходимо и достаточно. Ясно, что для сверхпродукции «связанного азота» клетки с такой системой регуляции не годятся. Эту последнюю трудность удалось преодолеть сравнительно легко.
Советский генетик С. В. Шестаков получил мутанты цианобактерий, которые выбрасывают все избыточные ионы аммония из цитоплазмы клеток в среду. Кроме того, у этих мутантов нарушена система, ответственная за подавление биосинтеза нитрогеназы ионами аммония. О получении подобных мутантов азотбактера сообщили недавно американские генетики. Такие мутантные микроорганизмы уже сами по себе могут оказаться очень полезными как сверхпродуценты асиммилируемого азота. Кроме того, они помогут выявить тот ген, который необходимо выключать, чтобы клетка могла бесконтрольно превращать азот в ионы аммония.
Значительно более сложными оказались проблемы энергетики фиксации азота и защиты нитрогеназы от отравления кислородом. Тем более что эти процессы противоречиво связаны. Чтобы получить достаточное количество АТФ для энергоемкого процесса фиксации азота, клетке надо дышать кислородом (бескислородный синтез АТФ — брожение — дает энергию примерно в 18 раз меньше). Но тот же кислород отравит нитрогеназу. Вставлять nif-гены в клетку с кислородным дыханием — все равно что разводить рыб на суше.
Каким же путем все-таки можно снизить расход энергии при превращении N2 в NH3, катализируемом нитрогеназой? Одно направление работ подсказывает рассмотренный нами механизм работы этого фермента. Давайте еще раз вернемся к рисунку. Как мы видим, значительная доля электронов (а следовательно, и значительная доля энергетических ресурсов в виде молекул АТФ) расходуется на восстановление ионов водорода — протонов (Н+) до молекул водорода. В среднем нитрогеназа расходует две молекулы АТФ на перенос одного электрона. Эта побочная реакция с точки зрения самого {176} процесса фиксации азота есть не что иное, как излишняя трата энергии. А что если образующийся молекулярный водород снова превратить в протоны и электроны: ведь электроны вновь могут быть использованы в нитрогеназной реакции? Клетка осуществляет такое превращение водорода с помощью фермента гидрогеназы. Этот фермент, а также ряд других белков, способствующих превращению газообразного водорода в протоны и электроны, закодированы в так называемых hup-генах. Оказывается, что некоторые дикие штаммы Ризобиум уже содержат hup-гены, и урожай бобовых, живующих в симбиозе с такими бактериями, всегда намного выше, чем у растений, в клубеньках которых бактерии обычные.
Таким образом, при конструировании новых фиксирующих азот организмов генетики предполагают наряду с nif-генами вводить в клетки hup-гены (гены «захвата» молекулярного водорода). Источником таких генов будут скорее всего легкодоступные бактерии из рода Псевдомонас, способные расщеплять нефтепродукты, у которых hup-гены находятся в составе специальных плазмид (т. е. уже от природы встроены в векторы).
Другой, не менее важный путь преодоления «энергетического кризиса», связанного с введением в организм nif-генов, лежит в направленном совершенствовании энергетики этого организма.
Известно, что для всех зеленых растений, а также для многих микроорганизмов (сине-зеленых, например) основным источником энергии служит солнечный свет. В результате процесса фотосинтеза с помощью молекул пигмента хлорофилла, главного участника преобразования световой энергии в химическую, из воды и углекислого газа образуются углеводы и молекулярный кислород. Благодаря фотосинтезу в этих организмах идет также образование аденозинтрифосфата и других переносчиков энергии.
Оказывается, эффективность фотосинтетической фиксации СО2 также можно повысить генетическим путем. Ясно, что это перспективно не только для фиксации азота, но и для повышения общей продуктивности растения. Дело в том, что фермент карбоксилаза — ключевой катализатор фиксации углекислого газа — так же, как и нитрогеназа, наряду с основной полезной реакцией (ведущей к синтезу источников углеводов) катализирует {177} побочную и бесполезную с точки зрения синтеза источников энергии реакцию, которая в конечном итоге приводит вновь к освобождению СO2. Эту реакцию можно подавить, если, например, выращивать растение в атмосфере, обогащенной углекислым газом. Однако изменять состав атмосферы, в которой растут сельскохозяйственные растения, слишком дорого (это можно делать только в теплицах). Генетики пошли другим путем. Они получили такие мутантные формы фермента карбоксилазы, которые потеряли способность катализировать побочную реакцию и тем самым направили фиксируемый углекислый газ только на синтез углеводов.
Очень интересная возможность в повышении эффективности использования продуктов фотосинтеза заключена в усовершенствовании ферментативных систем «метаболизма» воды. Молекулы воды при фотосинтезе служат источником электронов, используемых для образования АТФ. Недавно у цианобактерий удалось найти гены (так называемые lit-гены), в которых закодированы белки, расщепляющие молекулы воды. Генетики надеются, увеличивая число таких генов в клетках фотосинтетиков, существенно улучшить их энергетику.
Чему нас могут научить бактерии. Теперь давайте посмотрим, как обстоит дело с защитой нитрогеназы от кислорода у разных фиксирующих азот атмосферы организмов. У таких бактерий, как Клебсиелла, этой проблемы вообще не существует. Ведь Клебсиелла усваивает атмосферный азот только тогда, когда она живет в анаэробных (бескислородных) условиях. Она, как говорят микробиологи, факультативный анаэроб. В присутствии О2 эти бактерии могут расти только на готовых источниках азота. Их нитрогеназа при этом не только не работает, но и не синтезируется. Да и в знаменитом опыте, когда nif-гены из Клебсиеллы заработали в кишечной палочке, эта бактерия фиксировала азот тоже только в анаэробных условиях. Ведь в нашем кишечнике она живет без кислорода, получая энергию благодаря сбраживанию углеводов. Таким образом, Клебсиелла не может быть использована для спасения нитрогеназы от кислорода. Азотфиксатор из рода Клостридиум также не может помочь: клостридии — облигатные (обязательные) анаэробы, гибнущие в кислородной среде.
Другое дело цианобактерий. Как вы уже знаете, у цианобактерий, фиксирующих азот атмосферы {178} (например, у анабены, живущей в симбиозе с азоллой — мелким водяным папоротником), наряду с нормальными пигментированными клетками (ведь цианобактерии — это фотосинтетики) имеются присоединенные к ним дополнительные клетки, названные гетероцистами. Гетероцисты возникают у анабены только тогда, когда у них нет для питания другого источника азота, кроме атмосферного. Если кормить ее солями аммония или селитрой, то гетероцисты исчезают. У анабены, фиксирующей азот атмосферы, вся нитрогеназа содержится в гетероцистах; причем клеточные стенки гетероцистов устроены так, что доступ кислороду в них закрыт. По последним данным, в гетероцистах то небольшое количество кислорода, которое вместе с азотом проникает через оболочки, активно связывается особыми реакциями. Все же необходимые для работы нитрогеназы источники энергии поступают в гетероцисты из нормальных соседних фото-синтезирующих клеток. Таким образом, гетероцисты — это не что иное, как специализированные фабрики азотистого питания, сырьем для которых служит азот атмосферы, а энергетическим источником — солнечный свет.
Эффективность гетероцист как защитного средства демонстрируется простым опытом: связывание азота идет и в бесклеточных экстрактах из сине-зеленых, но только в бескислородной среде. При 5% кислорода нитрогеназа, не защищенная гетероцистами, отравляется за считанные минуты, а ведь в воздухе кислорода в 4 раза больше. Даже 0,1% кислорода заметно подавляет синтез иона аммония.
Любопытно, что ископаемые остатки сине-зеленых, содержащих гетероцисты, обнаружены в отложениях возрастом около 2,2 млрд. лет. Более ранние отпечатки цианобактерии гетероцист не имеют. Значит, кислород стал поступать в атмосферу Земли немногим ранее 2 млрд. лет назад; следовательно, и кислородное дыхание не может быть старше. Человек, попавший в такую атмосферу, задохнулся бы мгновенно. Значит, если вставлять азотфиксирующие гены в хлоропласты, необходимо превратить эти органеллы во что-то вроде гетероцист, но внутриклеточных симбионтов высшего растения. У таких растений будут и нормальные хлоропласты, и новые органеллы — «нитропласты».
Замечательная система защиты нитрогеназы выработалась у Ризобиум. Напомним, что этот важнейший {179} фиксатор атмосферного азота живет в симбиозе с бобовыми растениями. Ризобиум, проникая в клетки корней бобовых, вызывает на них образование клубеньков. В клубеньках Ризобиум разрастается в своеобразные колонии клеток, окруженные плотным слоем клеток растения. Вот эти растительные клетки и вырабатывают белок, защищающий нитрогеназу от кислорода. Интересно, что этот белок оказался аналогом гемоглобина крови — белка — переносчика кислорода у человека и животных. Поэтому он был назван леггемоглобином (лег от английского legume — бобовые). Гемоглобин крови состоит из двух частей: белковой (глобина) и железо-порфириновой (гема), которая собственно и связывает кислород. Такие же две части синтезируются клетками растений, а железопорфириновая (гем) — клетками Ризобиум. Таким образом, растительные клубеньковые клетки растения снабжают клетки Ризобиум глобином, который, соединяясь в них с гемом, образует леггемоглобин, связывающий главного «врага» нитрогеназы — молекулярный кислород. Поэтому скопления Ризобиум в клубеньках всегда окрашены в красный цвет. Из клеток растения в Ризобиум поступают также источники энергии в виде продуктов фотосинтеза (они образуются в листьях растения и затем транспортируются в его корневую систему), а Ризобиум питает растение фиксированным азотом атмосферы. Так выглядит симбиоз растения и микроорганизма на биохимическом уровне.
Многому можно научиться у азотобактера. Он живет не только вне растений, но и в кислородсодержащей среде. Тем не менее его нитрогеназа исправно работает. Происходит это потому, что азотобактер очень интенсивно дышит и быстро расходует весь кислород, который проникает в его клетки. Но даже если затруднить дыхание азотобактера, то он не сразу прекращает существование. Его клетки начинают вырабатывать так называемый Fe-S-белок, т. е. белок, содержащий железо и серу. Достаточно одной молекуле такого белка связаться с нитрогеназой, чтобы обезопасить ее от кислорода. В комплексе с Fe-S-белком нитрогеназа практически не работает, но зато стоит убрать кислород, и этот белок как активность фермента полностью восстанавливается (вспомним, что незащищенную нитрогеназу кислород отравляет необратимо). Сейчас генетики сумели разобраться, в каком из генов азотобактера закодирован {180} Fe-S-белок. Этот ген также будет необходим при создании новых организмов, фиксирующих азот атмосферы.
Известно далеко не все о том, какие еще существуют выработанные природой способы защиты нитрогеназы от кислорода. Так, клубеньковые микроорганизмы, живущие в симбиозе с ольхой, обходятся без леггемоглобина. Ясно, что какое-то противоядие от кислорода у них есть. Добавим, что пока известны далеко не все биохимические фиксаторы азота, в арсенале природы наверняка имеется их немало.
Теперь, кажется, известно, как спланировать работу по созданию зеленого растения, фиксирующего атмосферный азот без помощи микроорганизмов. Для этого нужно:
— выделить гены азотофиксации из любого фиксирующего азота атмосферы организма, который заранее превращен в сверхпродуцент NH4 (т. е. организм с де-репрессированным синтезом нитрогеназы);
— перенести их стандартными методами генетической инженерии в Т-ДНК в район Ti-плазмиды;
— перенести в эти же плазмиды гены, кодирующие синтез леггемоглобина, который защитит нитрогеназу от кислорода;
— включить в эти плазмиды гены энергетического обеспечения работы нитрогеназы (hup, lit, а также гены «улучшенной» карбоксилазы);
— трансформировать этими рекомбинантными Ti-плазмидами клетки растения.
К сожалению, время для таких прямых опытов еще не пришло: мы слишком мало знаем о физиологии и генетическом аппарате растительных клеток, чтобы рассчитывать на быстрый успех.
Но ведь проблема увеличения пищевых ресурсов требует немедленного разрешения: уже сейчас сотни миллионов людей в слаборазвитых странах страдают от постоянного недостатка белковых продуктов, а по данным ООН на земном шаре каждые 4 секунды от недоедания умирает один ребенок. Поэтому ученые, изучающие биологическую фиксацию азота, направляют усилия на решение более реальных задач.
Во-первых, это конструирование новых фиксирующих азот микроорганизмов-фотосинтетиков, которые усваивают атмосферный азот благодаря солнечной энергии. Кроме того, ученые научились превращать их в такие формы, которые выбрасывают все избыточные {181} азотистые соединения в среду. Следовательно, остается создать более продуктивные по синтезу аммиака штаммы этих микроорганизмов.
Основное требование к новым формам азотфиксаторов — более интенсивная фиксация азота атмосферы при тех же (или даже меньших) затратах энергии. Дикие клубеньковые бактерии можно улучшить, как человек улучшил грибок — продуцент пенициллина, заставив его синтезировать антибиотик в тысячи раз активнее. Вы уже познакомились с тем, каким образом генетики решают подобные задачи: это освобождение нитрогеназы от зависимости концентрации ионов аммония в клетке, введение в клетку генов гидрогеназы, увеличение фотосинтетических возможностей самого растения и т. д. Правда, в реальных полевых условиях «новички» должны сосуществовать с огромным миром микроорганизмов, населяющих почву. А главное, они должны выдерживать борьбу за существование и побеждать в этой борьбе со своими непосредственными родственниками — клубеньковыми бактериями, которые привыкли жить в симбиозе с растением. Это сложная проблема: ведь высшие культурные растения, как правило, оказываются «побитыми» дикими сорняками. Вот почему ученые, создавая новые формы микроорганизмов, сразу отбирают те из них, которые способны выдержать конкуренцию с хозяевами почвы. В последние годы микробиологи и генетики добились серьезных успехов в повышении урожайности соевых бобов, сконструировав для них новые штаммы Ризобиум. Соя, как известно, — один из основных поставщиков полноценного белка сейчас и в ближайшем будущем.
Решая проблему «азотного голода», генетики не только улучшают известные виды азотфиксирующих симбионтов, но и работают над созданием новых почвенных микроорганизмов. Дело в том, что, кроме клубеньковых бактерий, живущих на корнях лишь немногих растений, в ризосфере (так называют корневую систему с прилегающей к ней почвой) любого растения обитает богатейший и специально приспособленный к ней мир микроорганизмов. Некоторые из них живут непосредственно на корнях растений, другие — возле них. Ризосферные микробы питаются в значительной мере выделениями корней, но и сами снабжают растения полезными продуктами своей жизнедеятельности. {182}
К сожалению, в ризосферной микрофлоре очень мало видов, фиксирующих атмосферный азот. Свободноживущие азотфиксаторы, например азотобактер, почему-то предпочитают жить вне ризосферы. Микробиологи и генетики пытаются сейчас выяснить этот вопрос. Какие особенности генетического аппарата ризосферных бактерий заставляют их из поколения в поколение селиться на корнях высших растений? Кое-что ясно уже сейчас. В состав клеточной стенки бактерий входят специальные сложные углеводы — полисахариды с составом, характерным для каждого определенного вида. Эти специфичные для вида вещества и помогают бактериям «узнать» на стенке клеток, слагающих оболочку корня, специальные места (рецепторы) и приклеиться к ним. Такое взаимное «узнавание» обязательно происходит и у клубеньковых бактерий, и корней бобовых, прежде чем бактерии проникнут внутрь корня. Все это удивительно напоминает «узнавание» антителом своего антигена.
У клубеньковых бактерий гены «узнавания» недавно были найдены в составе плазмид. Это открытие трудно переоценить. Ведь с помощью таких генов можно «приручить» к растениям мощные фиксаторы азота, которые чуждаются ризосферы, или приучить ризосферных азот-фиксаторов (например, азоспирилл) к другому хозяину. На каждом пути перед исследователями встают трудности.
Ризосферные бактерии привыкли жить вместе с другими обитателями корневой системы; поэтому им, наверное, легче выстоять в борьбе за существование при смене хозяина. В сельском хозяйстве давно применяется препарат «нитрагин» — масса подсушенных клубеньковых бактерий, которой заражают семена бобовых перед посевом. Ученые надеются на основе новых форм азотобактера, «прирученного» к специфическим условиям ризосферы, или новых форм азоспирилл создать эффективные биологические азотные удобрения — новые «азобактерин» и «спириллин».
Другой путь: среди постоянных жителей ризосферы полезных сельскохозяйственных растений, например пшеницы, найти такие ризосферные микроорганизмы, которые легко превратить в азотфиксаторов. Для этого нужно перенести в них nif-гены и другие гены, обеспечивающие энергетику работы нитрогеназы и защиту этого фермента от кислорода. {183}
Оптимисты считали, что такие формы ризосферных микроорганизмов будут получены к 1985 г., пессимисты отодвигали этот срок до 1990 г. Как видим, надежды возлагались на ближайшее будущее. В печати появилось сообщение, что австралийским ученым удалось вставить бактериальные гены в клетки томатов, и теперь растение «может брать необходимый для жизни азот непосредственно из воздуха, не нуждаясь более в минеральных удобрениях». Увы, нитрогеназа в клетках томата будет бесполезным грузом.
Наш рассказ будет неполным, если не упомянуть еще об одной, на первый взгляд фантастической идее — создать азотфиксирующих животных! Казалось бы, невероятно. Однако это более реально, чем азотфиксирующие томаты. Речь снова идет о микроорганизмах, только живущих в качестве симбионтов и комменсалов (нахлебников) в желудочно-кишечном тракте. То небольшое количество воздуха, которое в нем имеется, практически не содержит кислорода в отличие от плазмы клеток. Если создать азотфиксирующих энтеробактерий (а это нетрудно, вспомним про ближайшую родственницу кишечной палочки — Клебсиеллу) и придать им способность сосуществовать с нормальной микрофлорой кишечника, то, фиксируя молекулярный азот, такие бактерии могли бы стать полезным источником азотного питания животных. А может быть, и людей? В научной литературе встречались непроверенные спорные сообщения, что в кишечниках аборигенных обитателей влажного тропического леса, пища которых содержит недостаточно белков, имеются азотфиксирующие бактерии.
Приведем и достоверный факт. Южные насекомые — термиты (их называют «белыми муравьями», хотя они близки к тараканам) — могут неограниченное время питаться одной клетчаткой (например, фильтровальной бумагой). Сами термиты клетчатку (целлюлозу) не переваривают, за них это делают микроорганизмы-симбионты, обитающие в их кишечниках. Среди них есть и азотфиксаторы: ведь клетчатка азота не содержит. В конечном счете термиты питаются не клетчаткой, а своими симбионтами. Но стоит термитов подержать при повышенном давлении кислорода, как он, проникнув в пищеварительный тракт, отравит нитрогеназы симбионтов, погибнет вся микрофлора кишечника, и термитам одной клетчатки будет недостаточно. Стерильным термитам {184} нужны аминокислоты, на «диете» из одной фильтровальной бумаги они погибнут с голоду.
Аналогичные симбионты, выведенные для домашних животных, решили бы проблему кормов самым радикальным образом. И здесь оптимисты предсказывают появление соответствующих бактериальных препаратов в ближайшем будущем.
Футурологи, пытаются предсказать будущее, приходят к печальному прогнозу. Если сельское хозяйство будет развиваться прежними путями, к 2000 г. на Земле будет недоедать около 2 млрд. людей. Требуются новые, оригинальные решения для того, чтобы обеспечить человечество пищевыми продуктами, и в первую очередь белком. Большую помощь в этом может оказать генная инженерия.
Сельское хозяйство к 2000 г. должно основываться на новых сортах растений, в первую очередь злаковых и бобовых. Пшеница, рожь, рис, кукуруза, соя и другие зернобобовые долго еще останутся основными кормильцами человечества. Но они приобретут невиданные свойства. Будущие злаки, как и бобовые, смогут обогащать почву азотом, не нуждаясь в азотных удобрениях, благодаря симбиотическим азотфиксирующим бактериям. Они освободятся от вирусов и приобретут устойчивость к грибковым и бактериальным заболеваниям. Наконец, зерно их будет содержать значительно большее, чем сейчас, количество белков, в первую очередь богатых незаменимыми аминокислотами. Хлеб из такого зерна по пищевой ценности приблизится к мясу или рыбе. Все это возможно было бы сделать уже сейчас или в ближайшие 10—15 лет.
Сейчас же каждую весну на миллионах гектаров поверхность планеты скальпируется плугами и боронами, насыщается инсектицидами и минеральными удобрениями. И все это ценой затрат огромного труда, расхода невосполнимых нефтепродуктов. И так с весны до осени, каждый год. В результате площадь, пригодная под пашню, сокращается, земля разъедается эрозией. Еще больший вред приносит засолонение поливных полей, занятых хлопком и рисом. Пустыня наступает везде, не только в Сахаре. Ф. Энгельс предсказывал это, когда писал, что за каждый крупный успех природа мстит человеку.
Где же выход? Его давно предсказывали ученые. {185} Соратник Ч. Дарвина А. Уоллес писал, что со временем сахарная пальма вытеснит сахарный тростник, «так как для ее культуры не нужно ни удобрения, ни обработки земли, да и почва истощалась бы далеко не так быстро». Может быть, А. Уоллес ошибался относительно именно пальмы: похоже, углеводами нас обеспечит биотехнология. Но общий принцип угадан правильно — деревья вместо однолетних трав!
Наш известный палеонтолог, геолог и писатель-фантаст И. А. Ефремов так характеризует сельское хозяйство через тысячу лет: «...отпало трудоемкое ежегодное выращивание травянистых и кустарниковых растений. Деревья, долголетние, слабее истощающие почву, устойчивые к климатическим невзгодам, стали основными сельскохозяйственными растениями».
Итак, деревья — хлебные и ягодные, плодовые и ореховые, которые можно выращивать и на склонах гор, не истощающие и не иссушающие почву. Прообраз их — яблоневые и ореховые леса предгорий нашей средней Азии.
Если деревья выгоднее — почему земледельцы так привержены к однолетним злакам? Необходимо помнить, что революционная перестройка жизненно важной отрасли — дело неимоверно трудное.
Сто лет назад великий химик Д. И. Менделеев сказал: «Нефть не топливо, топить можно и ассигнациями». Сейчас слова его приобрели еще больший смысл. Ведь из нефти мы можем делать не только пластмассы, полимеры, красители, лекарства и многое другое, но и, применяя биотехнологические методы, кормовой и пищевой белок. А нефть до сих пор «вылетает в трубу», вернее в выхлопные трубы двигателей внутреннего сгорания.
Замены двигателю внутреннего сгорания на автомобилях, тракторах, комбайнах, стационарных дизелях до сих пор нет. Экономичные и легкие электрические аккумуляторы еще не вышли из стен лабораторий. И нескоро они вытеснят дизеля: надо закрывать тысячи старых заводов, строить тысячи новых, переучивать сотни тысяч специалистов.
Злаки пока еще заменить нечем. Хозяйственно ценные деревья (или хотя бы кустарники и многолетние злаки), которые пришли бы им на смену, еще придется создавать. И генная инженерия здесь должна сказать свое слово. {186}
По-видимому, растениеводство — вторая после медицины отрасль практической биологии, в которой генно-инженерные методы произведут решающие, революционные перестройки. Конечно, мы будем и дальше улучшать сорта пшеницы и других однолетников, потому что должны заботиться о себе и своих детях. Но мы должны подумать и о внуках и правнуках. А это значит, что вопрос о коренной перестройке растениеводства науке нужно решать уже сейчас. Ведь вопрос о выведении новых пород и видов деревьев с заданными свойствами настолько сложен, что для его разрешения и испытания в практике требуются многие десятилетия. И решать его придется кому-то из читателей нашей книги.
| {187} |
Каждый год в разгаре лета в нескольких школах-интернатах Нью-Хэмпшира, расположенного на северо-востоке США, устраиваются знаменитые Гордоновские конференции. Ученые, в основном биологи и химики, обсуждают самые животрепещущие вопросы своей науки. Живописные отроги Белых гор, изумрудная зелень, голубые озера и кристально чистый воздух располагают к творческим беседам и дискуссиям, которые длятся с утра до поздней ночи. Гордоновские конференции славятся своей дружелюбной атмосферой.
Однако Гордоновская конференция по нуклеиновым кислотам, собравшаяся в июне 1973 г. по традиции в Ньюхэмптоновской средней школе, бурлила и гудела как растревоженный улей. Ее участники только что услышали о первых удачных попытках отклонировать гены насекомых и животных в бактериальных клетках. Возникшие здесь слова «генная инженерия» и «рекомбинантные ДНК» не сходили с уст споривших. Они будоражили умы и наполняли надеждами, но одновременно и порождали тревожные чувства. Ведь многие ученые стали развивать планы о применении генной инженерии в изучении онкогенных (раковых) вирусов. Для этого намеревались с помощью техники рекомбинантных ДНК перенести геном таких вирусов в клетки кишечной палочки. Высказывались опасения, что бактерия с раковым геном случайно может попасть в организм человека.
Еще до окончания конференции ее участники обратились к президенту Национальной академии наук с {188} предложением организовать комиссию по рекомбинантным ДНК, которая бы оценила степень опасности их создания для работающих с ними и для окружающей среды. Комиссия была создана. В нее вошли крупнейшие американские биологи, в том числе один из первооткрывателей двойной спирали ДНК Дж. Уотсон, а также «отцы» генной инженерии П. Берг, Г. Бойер, С. Коен.
В середине 1974 г. комиссия опубликовала обращение в виде открытого письма ко всем молекулярным биологам и генетикам мира, в котором призвала их воздержаться от конструирования некоторых видов рекомбинантных ДНК до тех пор, пока не будет полностью оценена степень риска с ними и не будут разработаны специальные правила безопасности. В частности, она не рекомендовала проводить эксперименты по клонированию генов онковирусов и других болезнетворных вирусов в клетках микроорганизмов, способных обитать в организме человека. Она призвала ученых тщательно продумывать каждый эксперимент, в котором используются ДНК, несущие гены устойчивости к антибиотикам. Комиссия предложила созвать международную конференцию по генной инженерии.
Публикация этого письма вызвала международный резонанс. Благородный и ответственный шаг членов комиссии послужил поводом к нападкам на науку и ученых. Генетическая инженерия была атакована как «изнутри», так и «снаружи». Некоторые сообщества либерально настроенных американских ученых («Наука для людей», «Друзья земли», «Коалиция за ответственность в генетических исследованиях») еще раз воспользовались случаем, чтобы напомнить об ответственности представителей науки за социальные последствия их научных открытий. Они использовали дискуссии о потенциальном риске работы с рекомбинантными ДНК, чтобы обратить внимание общественности на тяжелое состояние государственной системы медицинского обслуживания во многих штатах США, на непрекращающееся отравление окружающей среды химическими концернами. Они сразу предупредили, что частные компании постараются извлечь из нового замечательного достижения науки крупные барыши. Ведь инсулин человека, например, производимый бактериями, обойдется им намного дешевле, чем инсулин, извлекаемый из {189} поджелудочной железы свиньи. А продавать его они будут дороже, ссылаясь на то, что это настоящий человеческий инсулин, а не его заменитель.
Конечно, понять критиков генетической инженерии, выступавших с таких прогрессивных позиций, можно.
Иное дело — правые силы США. Многочисленные политические деятели увидели в рекомбинантных ДНК великолепный объект для демонстрации «заботы» о своих избирателях. Здесь легко нажить политический капитал, да и запугать обывателя. И политиканы пошли в бой. Им противостояла горстка ученых, которые, по словам политиканов, пускают на ветер деньги налогоплательщиков, удовлетворяя свое любопытство.
Особенно отличился Альфред Велуччи, мэр Кембриджа, пригорода Бостона, в котором расположены всемирно известные Гарвардский университет и Массачузетский технологический институт. Ему удалось настолько запугать городской совет, что все исследования по генной инженерии в этих ведущих научных центрах США были на некоторое время запрещены.
Один из авторов этой книги во время «кембриджского скандала» читал лекции в одном из университетов недалеко от Бостона. В гостях у одного из коллег его познакомили с респектабельной жительницей Кембриджа, которая, узнав, что автор изучает нуклеиновые кислоты, в ужасе воскликнула: «Так вы, значит, один из тех, кто хочет превратить наших детей в безмозглых карликов. Ну ничего, мэр Велуччи найдет на вас управу!» Что же касается «научного» уровня мэра Велуччи, то его лучше всего характеризует письмо, которое он написал президенту Национальной академии наук США. Это письмо настолько курьезно, что его стоит привести здесь полностью.
|
Мистеру Филипу Хендлеру, Президенту Национальной академии наук, Вашингтон |
16 мая 1977 г. |
Уважаемый мистер Хендлер!
Имею честь обратиться к вам с просьбой как мэр города Кембриджа.
Сегодня в газете «Бостон Геральд Америкэн», издаваемой {190} концерном Херста, появились два сообщения, весьма меня обеспокоивших. В Дувере, штат Массачузетс, объявилось «странное существо с оранжевыми глазами», а в Холлисе, штат Нью-Хэмпшир, перед одним человеком и двумя его сыновьями предстало «волосатое существо высотой в девять футов».
Убедительно прошу Вашу уважаемую организацию изучить эти происшествия. Я очень надеюсь, что Вы сможете установить, не связано ли появление этих «странных существ» с экспериментами по рекомбинантным ДНК, производимыми у нас в Новой Англии.
Заранее благодарен за помощь, с чем и остаюсь искренне ваш
Альфред Е. Велуччи, мэр, город Кембридж,
Массачузетс.
Мэр Велуччи оказался не одинок: временные запреты на генетическую инженерию удалось протащить еще в нескольких университетских городах США.
В такой ситуации ученые сохраняли стойкость. Весной 1975 г. в курортном местечке Асиломар, неподалеку от Сан-Франциско, была созвана первая международная конференция по рекомбинантным ДНК-Участвовала в ней и советская делегация во главе с выдающимся биохимиком В. А. Энгельгардтом. Нашим ученым было о чем рассказать: к этому времени в ряде институтов АН СССР по инициативе А. А. Баева развернулись широкие исследования по генетической инженерии. Конференция разработала правила работы с организмами, трансформированными рекомбинантными ДНК.
Между прочим, изобретать ничего нового участникам конференции не пришлось: уже десятки лет бактериологам и вирусологам приходилось иметь дело с действительно крайне опасными объектами, например с возбудителями чумы, холеры, сибирской язвы, с вирусом полиомиелита и многими другими. Ведь если бы не было таких работ, то не появились бы средства борьбы с этими болезнями, уносившими в прошлом тысячи человеческих жизней.
Участники Асиломарской конференции обратили внимание общественности, что генные инженеры работают и намерены работать в будущем только с такими штаммами кишечной палочки (нашего естественного симбионта), которые неспособны размножаться в организме человека или животных. Их можно выращивать только в лабораторных условиях на изысканных питательных средах. {191}
Правила работы с рекомбинантными ДНК были приняты во всех развитых странах мира. Сначала они были очень строгими. Но по мере того как накапливался опыт, правила упрощались, и сейчас они мало отличаются от правил техники безопасности работы с «до-генноинженерными» клетками. Работы с безопасными микроорганизмами ведутся в обычных лабораторных и заводских условиях. А с патогенными вирусами или микроорганизмами работают в специальных лабораториях, полностью изолированных от окружающей интенсивнейшей работы с рекомбинантными ДНК, в которую вовлечены тысячи людей, не зафиксировано ни одного случая, когда кто-либо пострадал бы от сконструированных генными инженерами организмов. По-видимому, случайным образом патогенные штаммы бактерии в ходе этих исследований возникнуть не могут.
Мы рассказали о тех опасениях, которые возникли после того, как человечество обрело невиданную до сих пор власть над геном. Изложим и нашу собственную точку зрения на этот трудный вопрос.
В конечном счете все страхи основываются на том, что генная инженерия позволяет преодолевать барьеры между организмами, которые прежде генами никогда не обменивались. Особенно опасаются случаев, когда в плазмидах клонируются гены высших организмов, особенно человека. Видимо, полагают, что геномы разных видов подобны компонентам так называемого бинарного газа, принятого на вооружение Пентагоном: порознь части безвредны, а в смеси образуют смертельный яд.
Однако клетки высших организмов, бактерий со всеми своими плазмидами и вирусы сосуществуют в биосфере миллиарды лет, не вызывая особых потрясений.
Еще более удобное место для незапланированных опытов по генной инженерии — человеческий кишечник. В нем, как и в кишках других животных, обитают бактерии, в первую очередь часто упоминавшаяся нами кишечная палочка и целый ряд других: симбионты, нахлебники и паразиты. Наш кишечник — это хемостат, прибор для поточного выращивания бактерий при заданной (36,7—37°С) температуре.
Каждый человек ежедневно съедает с пищей немало {192} чужой ДНК. Далеко не вся она становится непригодной для трансформации в результате термической обработки пищи при варении или жарке. Чужая ДНК расщепляется ферментами, выделяемыми поджелудочной железой. Эта железа занимается не только внутренней секрецией, поставляя в кровь инсулин и глюкагон, но и внешней, выделяя в просвет кишечника нуклеазы.
В результате действия нуклеаз возникают случайно расщепленные фрагменты ДНК и РНК. Но этого мало: каждый день со стенок нашего кишечника слущиваются целые граммы отмирающих клеток кишечного эпителия и вся их ДНК вступает в контакт с содержащими плазмиды бактериями. Другими словами, создаются идеальные условия для опытов с непредсказуемыми результатами. Так что в кишечнике любого человека такие эксперименты должны происходить каждый день.
Сторонники ограничений в генной инженерии опасаются, что новые, искусственные микроорганизмы выйдут из-под контроля, размножатся и погубят человечество. При этом забывают, что и сейчас, как и всегда в эволюции, для успеха недостаточно мутации или удачной генной рекомбинации; нужно еще, чтобы условия внешней среды или требования человека поддержали распространение той или иной генной комбинации. Иначе говоря, нужен отбор.
Трудности медицины, связанные с антибиотиками, обусловливаются именно тем, что врачи, применяя пенициллин или стрептомицин, вели отбор на устойчивость бактерий к факторам внешней среды. А как только «гены устойчивости», выведенные медиками, попали в трансмиссивные плазмиды, они стали распространяться в мире бактерий, которые постепенно переставали реагировать на антибиотики.
Недавно американские исследователи установили главную причину гибели цитрусовых и других южных растений в Калифорнии при заморозках. Оказалось, что в этом «повинны» безобидные бактерии из родов Псевдомонас и Эрвиния, обитающие на поверхности листьев. Сами бактерии питаются отмершими клетками листового эпидермиса и для растения безвредны. Но некоторые белки их оболочки являются центрами льдообразования: на них конденсируется {193} переохлажденный водяной пар и обмерзший лист гибнет.
Были получены штаммы бактерий, на которых не образуются микрокристаллы льда, и выдвинуто предложение опрыскивать их взвесью апельсиновые деревья. Это вызвало протест общественности, возглавляемой несколькими влиятельными сенаторами: как можно искусственно выведенные разновидности бактерий размножать и выпускать в природу!
Проект не был осуществлен, и, быть может, напрасно. Нет гарантии, что новые штаммы победят в жизненной борьбе клетки диких штаммов. Тем более нет оснований считать их вредными. Здесь все должен решить эксперимент.
Почему же надо опасаться ошибок генных инженеров? Ведь возможны и сознательная, направленная селекция, отбор вредных для человечества генных рекомбинаций, создание своего рода биологической ядерной бомбы.
Создание бактериологического оружия не требует больших капиталовложений, энергетических и материальных затрат, кроме того, может быть замаскировано безобидной и благородной целью, например изготовлением «чистых» вакцин. Слишком заманчив такой путь для стран, правительства которых упорно не желают объявить бактериологическую войну вне закона. Правда, такое оружие опасно и для того, кто его изготовляет. Выйдя из-под контроля, оно ударит и по народу собственной страны.
В 1969 г. в Вашингтоне было официально объявлено, что США отказываются от применения бактериологического оружия (именно потому, что оно может ударить по своим). А в 1986 г. заместитель помощника министра обороны США Д. Фейт заявил комиссии конгрессменов, что «поразительный прогресс, достигнутый за последние пять-десять лет в области биотехники... означает новые и лучшие биологические вооружения». Известно, что за последние 10 лет на эти исследования в США было затрачено 3 млрд. долларов. Американские газеты называют конкретные военные центры, работающие над этими проблемами. Известны и компании, например «Молекьюляр джинетекс», и фамилии ведущих специалистов, и даже объекты, которые пытаются «улучшить» методами генной инженерии. {194}
Конечно, подавляющее большинство американцев не разделяют агрессивных устремлений Пентагона. Именно благодаря некоторым из них сведения о планах военщины проникают в печать. Они же разоблачают клеветнические измышления в адрес Советского Союза.
Ученые нашей страны всемерно совершенствуют генную инженерию, чтобы развить и закрепить успехи в этой области современной биологии. Как всякое научное достижение генная инженерия (власть над геном) сама по себе морально нейтральна. Приемлемым или неприемлемым с точки зрения человечности можно рассматривать только ее практическое применение.
| {195} |
Размышлениями о проблемах, встающих перед человечеством, получившим власть над геном, мы и хотели закончить эту книгу. Но через полгода после того, как мы принесли рукопись книги в издательство и она уже готовилась к печати, нас попросили дополнить ее небольшим заключением.
И мы оказались перед сложной задачей. Полгода — очень короткий срок для любой из наук, но только не для генетической инженерии. За эти несколько месяцев появилось множество статей, описывающих новые векторы, расшифровку структуры генов, создание новых зондов для диагностики многих заболеваний человека и животных.
Главное же событие — начало разработки грандиозного проекта определения полной нуклеотидной последовательности генома человека (так называемая программа «Геном человека»). С таким великим замыслом биология еще не встречалась за всю историю своего существования: ведь предстоит изучить структуру ДНК общей длиной в 3 млрд. нуклеотидных остатков, что потребует объединения усилий многих тысяч людей. Проект, о возможности реализации которого еще нельзя было и думать года два назад, становится реальностью благодаря трем важным достижениям молекулярных биологов и генетиков самого последнего времени.
Во-первых, был создан метод электрофореза в гелях, позволяющий получать в индивидуальном виде целые хромосомы и их огромные фрагменты. Во-вторых, удалось сконструировать векторы для клонирования в клетках эукариот гигантских ДНК — длиной до миллиона пар оснований. И в-третьих, построены автоматы, секвенирующие ДНК с огромной скоростью. {196}
Конечно, для реализации проекта секвенирования генома человека нужно решить еще множество технических вопросов. Важно, что он осуществим в принципе. И не так уж далеко то время, когда мы будем знать структуру всех белков, из которых построен человеческий организм. А это поможет победить наследственные и многие другие болезни. Но об этом мы надеемся рассказать в следующих книгах.
Возможности генной инженерии год от года стремительно возрастают. Естественно, идут споры о том, как наиболее целесообразно использовать новые силы. Та же программа «Геном человека» вызвала ожесточенные споры в научном мире. Не утихают они и до сих пор. Противники программы настаивают на том, что слишком много сил и средств будет затрачено впустую: мы уже рассказывали о том, что гены, кодирующие белки, составляют лишь небольшую часть ДНК хромосом организмом. Да, отвечают сторонники программы, поиски нуклеотидных последовательностей в секвенируемых фрагментах человеческого генома будут подобны вымыванию частичек золота из золотоносной породы. Но ведь это — золото! Будет получена информация о полной структуре генов, поражаемых генетическими болезнями. Ученые надеются расшифровать структуру всех белков иммунной и гормональной системы человека, а также белков, участвующих в перерождении нормальных клеток в раковые. Кроме того, говорят защитники программы, работая над реализацией такого грандиозного проекта, ученые неизбежно создадут новые методы изучения генов, которые окажут воздействие на развитие всей биологии (подобно открытию рестриктаз и разработке способов секвенирования ДНК). И здесь они оказались правы.
Группа английских ученых, изучая гены человека, обнаружила в них особые области, с помощью которых ДНК одного человека может быть с полной достоверностью отличена от ДНК другого человека (кроме однояйцевых близнецов). Это открытие позволяет идентифицировать личность и устанавливать родство людей (оно получило название «молекулярная дактилоскопия»). Важно также, что этот метод помогает находить точные места генов (или, как говорят, картировать их) в хромосомах человека...
Известно, какой огромный ущерб сельскому хозяйству {197} наносят сорняки. Пока (и такая ситуация будет существовать еще многие годы) человечество в борьбе с сорняками идет по пути наименьшего сопротивления: посевы обрабатывают растительными ядами — гербицидами. Гербициды не только наносят большой вред окружающей среде, но они ядовиты и для основной культуры, будь то пшеница, картофель, бобы и т. д. Недавно группе балтийских ученых благодаря генноинженерным манипуляциям удалось получить сорт томатов, совершенно устойчивых к гербициду биалофосу. С биалофосом связывают большие надежды: он считается безвредным для человека и животных, а продукты его разложения (в основном аминокислоты) безвредны для растений и микроорганизмов. Однако он не может, естественно, отличить культурное растение от сорняка. И вот в хромосомы томата удалось ввести ген, в котором закодирован белок, обезвреживающий биалофос, но не влияющий на жизнедеятельность самого растения. Этим путем в ближайшие годы будут получены многие гербицидоустойчивые сельскохозяйственные растения. Будем надеяться, однако, что это большое научное достижение не обернется другой стороной и не приведет к бесконтрольному применению гербицидов. Ведь биалофос будет убивать не только сорняки, широкое его применение может значительно обеднить дикую флору. Противники биалофоса справедливо указывают на то, что применение, например, ДДТ погубило многие виды полезных насекомых (диких пчел, шмелей, наездников), а «вредные» смогли приспособиться, те же комары и мухи благоденствуют до сих пор.
Вот еще более сногсшибательный проект: вставить в геном картофеля ген хитиназы — фермента, расщепляющего хитин, слагающий оболочки насекомых. И если раньше колорадский жук переваривал съеденный им картофель, то тогда картофель, съедаемый вредителем, будет переваривать его самого!..
Генная хирургия — направленное изменение организма методом включения в его геном нужных генов — еще не вышла из лабораторий в клинику. Но опыты на лабораторных животных говорят о перспективности этого направления. Ограничимся одним примером. Мы писали в этой книге об энхансерах — последовательностях ДНК, делающих структурный ген активным (экспрессирующимся). Так, ген эластазы — фермента, {198} расщепляющего белок сухожилий — эластин — имеется во всех клетках организма, но активен он лишь в клетках поджелудочной железы, потому что только там он соединен с соответствующим энхансером. Американские исследователи вставили в плазмиду одновременно энхансер гена эластазы и ген дифтерийного токсина. Эту плазмиду вводили в яйцеклетки мышей, которые потом донашивались в матках приемных матерей. В результате рождались мышата без поджелудочной железы — энхансер стимулировал активность и гена эластазы, и гена токсина, убивающего клетку. Это, пожалуй, один из первых опытов, в котором удалось направленно повлиять на развитие ткани и целого органа. Следуя по этому пути, можно не только направленно убивать клетки (например, раковые), но и стимулировать синтез нужного клетке белка — в тех случаях, когда собственный ген организма дефектен.
Однако и тут возникают вопросы: куда мы зайдем, идя по этому пути? Возможно ли, например, с моральной стороны геннохирургически стимулировать рост головного мозга? Ведь как только мы научимся исправлять ошибки природы, нам тотчас захочется ее улучшить. А не ждать милостей от природы — на этом мы уже многократно обжигались. Хочется верить, что будущие генные инженеры будут осторожными в реализации своих проектов, смелость которых превзойдет, наверное, те, о которых мы вам рассказали.
| {199} |
Автотрофные, аутотрофные (по какому-либо веществу) клетки — способные сами синтезировать определенное вещество в отличие от ауксотрофных (см. Аксотрофные по какому-либо веществу клеток).
Активатор — регуляторный белок, по свойствам противоположный репрессору; он активирует транскрипцию (см. Репрессор; транскрипция).
Аллель, аллеломорф — форма существования гена; отличается последовательностями нуклеотидов. Обычно ядерные организмы имеют два аллеля каждого гена в гомологичных хромосомах, унаследованных от отца и матери; у половых клеток (гамет) с одним набором хромосом имеется только один аллель (закон чистоты гамет).
Антибиотики — вещества, подавляющие рост каких-нибудь клеток. Обычно антибиотики при этом блокируют одну из стадий синтеза белков или нуклеиновых кислот.
Антиген — вещество, воспринимаемое организмом как чужеродное и вызывающее иммунный ответ: соединение со специфичными белками — антителами (см. Антитела) или поглощение особыми клетками. Особенно антигенны белки и высокомолекулярные полисахариды, слагающие оболочки бактерий.
Антитело — белок (иммуноглобулин), синтезируемый организмом в ответ на введение антигена (см. Антиген). Комплекс антиген-антитело нерастворим, поглощается специальными клетками и переваривается ими или выводится из организма.
Ауксотрофные (по какому-либо веществу) клетки — неспособные синтезировать это вещества сами (в отличие от автотрофных).
Ауторадиография — способ обнаружения вещества, меченного радиоактивным изотопом, по засвеченному отпечатку на фотопленке. Для этого препарат, содержащий изотоп, накладывают на пленку и выдерживают в темноте нужное время.
Бактериофаг, фаг — вирус, размножающийся в бактериальных клетках. {200}
Белковая инженерия — создание искусственных белков с заданными свойствами обычно путем направленных изменений (мутаций) в генах природных белков.
Белок-химера — белок, часть аминокислотной последовательности которого кодируется одним геном, а часть — другим.
Библиотека генов, ген отека — собрание векторов (см. Вектор), в которых встроены фрагменты ДНК какого-либо организма, в совокупности слагающие весь его геном. Уже существуют и пополняются генотеки дрозофилы, мыши, человека и других видов.
Блоттинг — перенос ДНК из геля, в котором шел электрофорез, на нитроцеллюлозный фильтр. При этом ДНК собирается на фильтре, как чернила на «промокашке», давая точную картину распределения фрагментов ДНК по длине.
Вакцина — антигены (см. Антиген), которые вводят в организм, чтобы выработать против них иммунитет. Обычно состоит из убитых или ослабленных вирусов, или бактерий, или чистых оболочечных антигенов.
Вектор — полученная из плазмиды (см. Плазмида) или вирусной ДНК кольцевая молекула ДНК, способная переносить какой-либо ген от одной клетки к другой.
Водородная связь — образуется между электроотрицательным атомом молекулы (кислород, азот) и электроположительным ядром водорода (протоном), который, в свою очередь, ковалентно связан с другим электроотрицательным атомом той же или соседней молекулы.
β-Галактозидаза (бета-галактозидаза) — фермент, отщепляющий простой сахар — галактозу — от сложного молочного сахара — лактозы.
Гены-регуляторы — гены, кодирующие регуляторные белки, активирующие или подавляющие транскрипцию (см. Транскрипция) других генов.
Гетерозиготность — в отличие от гомозиготности тот случай, когда от отца и матери организм получает разные аллели (см. Аллель, аллеломорф).
Гибридизация ДНК — образование в опыте двуцепочечной ДНК, комплементарные половины которой получены из разных источников.
Гомозиготность — по какому-либо гену тот случай, когда мы от отца и от матери получаем одинаковый аллель (см. Аллель, аллеломорф).
Денатурация — обратимый распад двуцепочечной структуры ДНК под действием высокой температуры или щелочной реакции среды.
ДНК-лигаза — фермент, образующий фосфодиэфирную связь между двумя соседними остатками и тем самым зашивающий разрывы в полинуклеотидных цепях двутяжевой ДНК. {201}
ДНК-полимераза — катализирует синтез ДНК, используя в качестве «затравки» однотяжевую ДНК.
Доминантность — участие только одного аллеля в формировании признака у гетерозиготной (см. Гетерозиготность) особи. Если признак определяется совместным действием обоих аллелей, они называются кодоминантными.
Затравка (праймер) — короткая олиго- или полинуклеотидная последовательность со свободной 3' — ОН-группой, комплементарно связанная с однотяжевой ДНК или РНК; с ее 3'-конца ДНК-полимераза начинает наращивать полидезоксирибонуклеотидную цепь.
Индуктор — вещество, которое, попадая в клетку, «включает» транскрипцию (см. Транскрипция) прежде репрессированного гена (см. Репрессор).
Инициация — процесс, обеспечивающий начало репликации ДНК, транскрипции или синтеза полипептидной цепи белка на рибосоме.
Интерфероны — защитные белки организма, подавляющие рост вирусов и клеток злокачественных опухолей. Синтезируются лейкоцитами (а- и Y-интерфероны) и клетками соединительной ткани (в-ин-терферон).
Интрон — участок гена, который транскрибируется, а затем удаляется из предшественника РНК при сплайсинге (см. Сплайсинг), находится между двумя экзонами (см. Экзоны).
Кодон — три расположенных друг за другом нуклеотидных остатка в цепи информационной РНК, кодирующие одну аминокислоту или являющиеся сигналом окончания трансляции (см. Трансляция).
Компетентность — способность клеток к трансформации (см. Трансформация).
Комплементарность — соответствие молекул или их частей, приводящее к образованию комплекса, поддерживаемого водородными или иными связями. Комплементарны, например, пары оснований А—Т, G—С и А—U в нуклеиновых кислотах, антиген — антитело или активный центр молекулы фермента и субстрата этого фермента.
Конъюгация (соединение) — процесс обмена ДНК у бактерий. При этом клетка, отдающая ДНК (донор), присоединяется к клетке, принимающей ДНК (акцептору), трубочкой, стенки которой состоят из молекул белка — пилина.
Кроссинговер — обмен частями у гомологичных хромосом. Проходит обычно при становлении половых клеток — в мейозе, когда хромосомы, унаследованные от отца и матери, образуют пары (биваленты). Реже встречается при митозе (соматический кроссинговер).
Лактозный оперон кишечной палочки — совокупность трех генов, в которых закодированы ферменты, позволяющие клеткам кишечной палочки усваивать молочный сахар — лактозу.
Лизис — распад клетки, вызванный разрушением ее оболочки. {202}
Лизогенный (умеренный) фаг — бактеориофаг, ДНК которого встроена в хромосому бактериальной клетки и генетически неактивна из-за действия белка-репрессора (см. Репрессор). Удаление репрессора активирует ДНК, фаг размножается, и наступает лизис — распад клетки.
Линкер — короткий двутяжевой синтетический олигонуклеотид, применяемый для соединения фрагментов ДНК при получении рекомбинантных ДНК; часто содержит участок узнавания рестриктазой.
«Липкие» концы — комплементарные однотяжевые участки ДНК, выступающие из двойной спирали одной и той же или разных молекул ДНК; могут быть получены при разрезании ДНК многими рестриктазами; используются для направленного соединения («склеивания») фрагментов ДНК друг с другом.
Маркерный ген — ген в рекомбинантной ДНК, кодирующий признак, которого нет у клетки-реципиента; часто это — устойчивость к антибиотикам.
Метилазы — ферменты, которые, присоединяя метильную группу СН3 к одному из нуклеотидов ДНК, делают это место устойчивым к действию соответствующих рестриктаз.
Мутаген — вещество, способное вызвать мутацию (см. Мутация). Мутагенез — процесс возникновения мутаций.
Мутация — изменение генетического материала, приводящее часто к изменению свойств организма. Обычно это изменение числа хромосом или их структуры или же точковое изменение в последовательности нуклеотидов ДНК.
Нуклеазы — общее название ферментов, расщепляющих молекулы нуклеиновых кислот.
Олигонуклеотид — цепь, состоящая из нескольких (от 2 до 20) нуклеотидных остатков.
Онкорнавирус — РНК-содержащий вирус, вызывающий перерождение нормальных клеток в раковые; содержит в своем составе обратную транскриптазу.
Оператор — участок ДНК, с которым специфически связывается репрессор (см. Репрессор) и предотвращает начало транскрипции с соседнего промотора (см. Промотор).
Плазмиды — кольцевые молекулы ДНК, способные размножаться (реплицироваться) в клетке независимо от ядра. Различают п. трансмиссивные, способные передаваться от клетки к клетке, и нетрансмиссивные.
Полилинкер — то же, что и линкер (см. Линкер), но содержащий участки узнавания сразу для нескольких рестриктаз (см. Рестриктазы).
Полимеразы — ферменты, способные использовать полинуклеотиды {203} как матрицы и строить комплементарные им новые полинуклеотидные цепи.
Полипептид — полимер, состоящий из аминокислотных остатков, связанных пептидными связями.
Правые и левые молекулы — органические кислоты, большинство аминокислот, углеводы и прочие соединения с асимметрическим атомом углерода; могут существовать в двух формах — правой и левой, отличающихся друг от друга как перчатки с разных рук. Например, все аминокислоты, кодируемые ДНК, — левые.
Прокариоты — организмы, у которых нет клеточного ядра; все бактерии — прокариоты.
Промотор — сигнальная последовательность ДНК, которую «узнает» молекула фермента РНК-полнмеразы и соединяется с нею, чтобы начать транскрипцию (см. Транскрипция).
Протопласт — бактериальная, грибковая или растительная клетка, с которой специальными ферментами удалена оболочка.
Рекомбинантные молекулы ДНК — получаются в результате объединения, сшивки двух чужеродных фрагментов ДНК. Рекомбинация может быть естественной или искусственной, подготовленной генным инженером.
Ренатурация — у ДНК; процесс, обратный денатурации (см. Денатурация), т. е. объединение комплементарных цепей в двойную спираль. У белков — восстановление исходной (нативной) структуры за счет правильного образования всех внутренних связей (в том числе ковалентных S—S-связей).
Репликация — синтез дочерних цепей ДНК на цепях исходной молекулы ДНК; главный участник этого процесса — ДНК-полимераза.
Реп рессор — белок, который, присоединяясь к ДНК, делает ее генетически неактивной (тормозит процесс транскрипции; см. Транскрипция).
Рестриктазы — ферменты, расщепляющие ДНК по местам с определенной последовательностью нуклеотидов.
Рестрикты — фрагменты, кусочки ДНК, нарезанные рестриктазой (см. Рестриктазы).
Рестрикции — модификации системы — способ, с помощью которого бактерии защищаются от чужой (фаговой) ДНК. При этом чужая ДНК расщепляется по определенным местам ферментами — рестриктазами (см. Рестриктазы). Уязвимые места в своей ДНК и ДНК, приспособившихся к этой бактерии фагов, защищаются модификацией (метилированием), которую производят особые ферменты — метилазы.
Рестрикционная карта — схема молекулы ДНК, на которой указаны места разрезания ее различными рестриктазами; относительные {204} расстояния между этими местами соответствуют относительным длинам реально образующихся фрагментов ДНК.
Рецессивность — тот случай, когда аллель (см. Аллель), обладающий этим свойством, подавляется при развитии доминантным признаком (см. Доминантность).
Рибонуклеазы — ферменты, расщепляющие в клетках ставшую ненужной или чужую РНК.
Секвенирование — определение последовательности чередования нуклеотидных остатков в нуклеиновой кислоте или аминокислотных остатков в белке.
Селективные среды — твердые и жидкие питательные среды, на которых могут расти клетки лишь с определенными свойствами. Селективные среды производят селекцию, отбор.
Скрининг — поиск среди многих колоний клеток тех немногих, которые имеют в своем составе векторы с нужными генами (иногда просто поиск изменившейся в нужном направлении клетки).
Сплайсинг — процесс удаления нитронов из предшественника РНК и объединения экзонов в зрелую РНК.
Терминация — процесс, приводящий к окончанию репликации транскрипции или трансляции (см. Репликация; Транскрипция; Трансляция).
Трансдукция — перенос ДНК от клетки к клетке плазмидами (см. Плазм иды) и фагами.
Транскрипт — продукт транскрипции, т. е. РНК, синтезированная на данном участке ДНК (как на матрице) и комплементарная ему.
Транскриптаза обратная, ревертаза — фермент ДНК-полимераза, синтезирующий на однотяжевой РНК комплементарную ее однотяжевую ДНК; для своей работы требует «затравки» (см. ДНК-полимераза).
Транскрипция — синтез РНК на ДНК-матрице; осуществляется РНК-полимеразой.
Трансляция — процесс синтеза белковых молекул на матрицах информационных РНК.
Трансфекция (соединение слов трансформация и инфекция) — изменение (трансформация) наследственных свойств клетки с помощью заражения (инфекции) клетки фагом или фаговой ДНК со встроенным геном.
Трансформация (превращение) — изменение наследственных свойств клетки, происходящее, когда клетка захватывает чужую ДНК.
Усилитель (энхансер) - последовательность ДНК, которая, будучи расположена на любом расстоянии от какого-либо гена, резко (порой в 100—1000 раз) усиливает его транскрипцию (см. Транскрипция). {205}
Фактор F — плазмида, обеспечивающая у бактерий процесс конъюгации.
Штамм — линия клеток, ведущая начало от одной клетки-родоначальницы. Все клетки штамма генетически одинаковы.
Экзоны — части гена, в которых закодированы участки его продукта — РНК или белка; после выбрасывания интронов (см. Нитроны) и сплайсинга (см. Сплайсинг) экзоны оказываются связанными друг с другом в зрелой РНК.
Электрофорез — разделение электрически заряженных молекул в электрическом поле. Обычно ведется в поддерживающих средах — гелях типа плотного студня, чтобы разделяемые молекулы не так быстро «расплывались» из-за теплового движения.
Эндонуклеазы — ферменты, расщепляющие нить ДНК не с концов, а посередине. Различают неспецифичные и специфичные эндонуклеазы, например эндонуклеазы, рестрикции, рестриктазы, расщепляющие ДНК по определенным последовательностям (см. Рестрикции; Рестриктазы).
Эукариоты — организмы, клетки которых содержат ядра; ДНК ядер при делении вместе с ядерными белками — гистонами образует хромосомы.
| {206} |
1 Девушке маленького роста:
На то и меньше мой алмаз
Гранитной темной глыбы,
Чтобы дороже в сотни раз
Его ценить могли бы!
ОГЛАВЛЕНИЕ
3
ГЛАВА 1
КАК УЗНАЛИ О СУЩЕСТВОВАНИИ ГЕНОВ
4
ГЛАВА 2
17
ГЛАВА 3
КАК ГЕНЫ ПЕРЕДАЮТСЯ ИЗ КЛЕТКИ В КЛЕТКУ
41
ГЛАВА 4
КАК ГЕННЫЕ ИНЖЕНЕРЫ РАЗРЕЗАЮТ,
СКЛЕИВАЮТ, КОЛОНИРУЮТ ГЕНЫ
60
ГЛАВА 5
87
ГЛАВА 6
ГЕННАЯ ИНЖЕНЕРИЯ — ПЕРВЫЕ УСПЕХИ
104
ГЛАВА 7
ГЕННАЯ ИНЖЕНЕРИЯ И ПРАКТИЧЕСКАЯ
МИКРОБИОЛОГИЯ
141
ГЛАВА 8
ГЕННАЯ ИНЖЕНЕРИЯ — СЕЛЬСКОМУ ХОЗЯЙСТВУ
156
ГЛАВА 9
ГЕННАЯ ИНЖЕНЕРИЯ — ОПАСЕНИЯ И НАДЕЖДЫ
188
196
ТОЛКОВЫЙ СЛОВАРЬ
НАЧИНАЮЩЕГО
ГЕННОГО ИНЖЕНЕРА
200
| {206} |
Учебное издание
БОГДАНОВ АЛЕКСЕЙ АЛЕКСЕЕВИЧ
МЕДНИКОВ БОРИС МИХАЙЛОВИЧ
Власть над геном
Зав. редакцией Т. П. Крюкова
Редактор Л. А. Приходько
Художники Б. А. Гомон, Т. Я. Демина
Художественный редактор В. М. Прокофьев
Технический редактор Т. Е. Молозева
Корректор О. В. Ивашкина
ИБ № 11222
Сдано в набор 22.03.88. Подписано к печати 26.12.88. А05833. Формат 84×108/32. Бумага офсетная № 1. Гарнитура литературная. Печать офсет. Усл. печ л. 10,92. Усл. кр.-отт. 42,42. Уч.-изд. л. 11,17. Тираж 130 000 экз. Заказ № 2048. Цена 60 к.
Ордена Трудового Красного Знамени издательство «Просвещение» Государственного комитета РСФСР по делам издательств, полиграфии и книжной торговли. 129846, Москва, 3-й проезд Марьиной рощи, 41.
Ордена Трудового Красного Знамени Калининский полиграфический комбинат Союзполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли. 170024, г. Калинин, пр. Ленина, 5.